十字型微通道制備粒徑均一的纖維素層析介質
引言
微流芯片于20世紀90年代提出并逐步發展,利用合理設計的微通道,可實現流體的微調控,完成反應、分離和分析等過程。根據微通道形式的不同,分為H型、Y型、十字型、共流式、流體聚焦式和臺階式等。采用微流芯片制備粒徑均一的微球已成為研究的新熱點,所用材料包括海藻酸鈣、殼聚糖/三聚磷酸鈉、丙烯酰胺、明膠、乙基纖維素、水凝膠等,其中具有微流聚焦效應的十字型微通道使用最廣泛。對于固定床層析過程,粒度均一的介質可提高分辨率,減少床層壓降。鑒于微流芯片制備微球具有設備和操作簡單,微球單分散性好,粒徑可控等優勢,可成為層析微球制備的新方法。
再生纖維素微球具有合適的多孔結構、剛性和機械強度,以及良好的化學反應特性,可作為生物大分子層析分離的良好基質材料。但是,由于纖維素分子內和分子間具有很強的氫鍵作用,使得纖維素無法溶于水和普通有機溶劑,加工難度大。近年來發現一些離子液體可直接溶解纖維素,濃度可高達5%以上,其優良性能已受到廣泛關注,成為纖維素‘’綠色‘’加工的新方法。纖維素微球制備主要有噴射法和懸浮法兩類。對于噴射法,由合適的噴嘴將纖維素或其衍生物的溶液噴射到惰性介質或空氣中分散,制得微球的粒徑比較均勻,但設備要求高。懸浮分散法將纖維素溶液分散懸浮于不相溶的惰性介質中,再生形成微球。由于液滴懸浮分散難以均一,微球的粒徑分布比較寬,需要進一步篩分,以得到合適粒徑的微球,目前常用多糖介質多采用懸浮分散法制備。以離子液體[BMIM]CI為溶劑,采用反相懸浮法,已成功制備了纖維素微球,但粒徑分布較寬,主要用于擴張床吸附分離。
針對纖維素溶液黏度較高的特性,本文選用十字型微通道,采用離子液體1-乙基-3-甲基咪唑甲基磷酸[EMIM]MP直接溶解微晶纖維素,以纖維素溶液為水相,葵花籽油為油相,通過十字型微通道的聚焦分散作用,得到粒徑均一的微液滴,固化成纖維素微球,進一步偶聯DEAE配基作為離子交換介質,為研制新型纖維素層析介質打下基礎。
1材料與方法
1.1主要材料
微晶纖維素,上海恒信化學試劑有限公司,聚合度為250左右;1-乙基-3-甲基咪唑甲基磷酸,[EMIM]MP,法國Solvionic公司;金龍魚葵花籽油,豐益貿易有限公司;牛血清白蛋白(BSA),分子量67*10 3公司;鹽酸2-氯三乙胺;DEAE SeoharoseFF;Span和無水乙醇,市售分析純。
1.2纖維素微球制備
纖維素微球制備一般分為溶解、分散、固化、再生和后處理五個過程。由于多數離子液體溶解纖維素需要較高溫度(80-90攝氏度),而有機材料制成的微流芯片在高溫下容易變形,因此本文選用Fukaya等報道的離子液體[EMIM]MP,可在25攝氏度、5h溶解5%微晶纖維素(DP=250)。
纖維素微球的制備裝置見圖1。內有十字型微通道的微流芯片由臺灣成功大學林裕誠教授惠贈,主要包括以聚甲基丙烯酸甲酯為材質的三層平板,中間層利用激光雕蝕形成十字型微通道,上層是水相和油相入口,下層是微液滴出口。在前期研究基礎上,選擇45攝氏度的恒溫條件,以添加Span85的葵花籽油為油相,以合適濃度的纖維素-離子液體溶液為水相,通過十字型微通道將纖維素溶液剪切分散成粒徑均一的微液滴,滴入水中,攪拌促使纖維素再生,實現纖維素微球的固化成形。最后,用去離子水浸泡沖洗纖維素微球,去除殘余的離子液體。
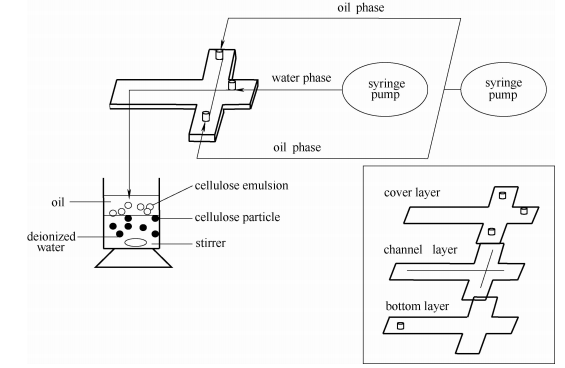
圖1微流芯片和纖維素微球制備示意圖
1.3PHP離子交換介質的制備
DEAE配基偶聯分為兩步;先將纖維素微球浸入強堿中堿化,然后加入鹽酸;:氯三乙胺,在適當溫度下偶聯形成陰離子交換介質。采用文獻方法,稱取2g抽干介質于25ml三角瓶中,加入4ml、5mol*L-1的鹽酸2-氯三乙胺溶液,于60攝氏度恒溫水浴搖床中預熱10min,取4ml、6mol*L-1的NaOH加入錐形瓶中,150r*min-1搖床反應2h;反應結束后迅速冷卻,用大量去離子水清洗,得到偶聯DEAE的纖維素層析介質,保存于20%乙醇中備用。
1.4液滴和微球粒徑分析
1.4.1微液滴直徑
采用顯微鏡法,用帶有標尺的光學顯微鏡,觀察微液滴,利用Image-proplus 5.0軟件隨機分析150個液滴的直徑,計算平均直徑8和分布系數CV
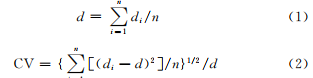
式中di為液滴的直徑,n為液滴數。
1.4.2微球粒徑分布
微球粒徑分布采用LS-230 Coulter激光粒徑儀分析。
1.5微球表觀形態
用濃度梯度逐步增大的乙醇溶液替換出微球中的水分,采用co2臨界點干燥儀干燥,通過掃描電鏡觀察微球的表面形態。
1.6微球基本物性
微球的濕真密度。含水率、孔度、孔容等基本物性參照文獻方法測定。
1.7離子交換容量
離子交換容量指單位質量介質中可交換的酸性或堿性基團的含量,本文采用AgNO3滴定法測定陰離子交換配基DEAE偶聯量。先使DEAE配基與C1-充分結合,然后加入過量Na2SO4溶液,用SO4置換出C1-,最后滴定測定置換出的C1-,計算離子交換容量。
1.8靜態吸附平衡
以BSA為模型吸附蛋白考察靜態吸附平衡。將介質用緩沖液。(平衡+);G3;抽濾,稱取約0.03g置于2ml離心管中,加入1ml不同濃度的BSA溶液;將離心管置于恒溫混勻儀中,25攝氏度下1000r*min-1振蕩3h;達到平衡后,取上清液280nm;測定BSA濃度。根據物料平衡計算吸附容量,本文以單位質量介質吸附[/B的質量來表示吸附容量。采用Langmuir吸附等溫式,擬合得到其飽和吸附容量和解離常數。
![]()
式中Q為平衡吸附容量,mg*(g介質);為吸附平衡后液相的蛋白濃度為
飽和吸附容量"; 為解離常數";

圖2 2%纖維素制備微球的電鏡分析照片
1.9吸附動力學
用緩沖液配制0.5mg*ml-1BSA溶液,取100ml置于三角瓶中,磁力攪拌器攪拌,由蠕動泵驅動,溶液經0.22um濾膜過濾,再經紫外檢測儀,循環回到三角瓶。當紫外檢測儀基線穩定后,將0.356g抽干介質加入到蛋白溶液中,紫外檢測儀實時檢測溶液中蛋白濃度的變化,繪制隨時間變化的吸附動力學曲線。
2結果與討論
2.1纖維素濃度的影響
纖維素濃度是纖維素微球制備的關鍵因素,不僅決定離子液體溶解纖維素的時間,還影響纖維素:離子液體溶液的黏度,從而影響微通道內的流型和微液滴的形成。隨著纖維素濃度的增加,纖維素:離子液體溶液的黏度顯著增加。實驗發現,過高黏度的纖維素溶液不利于形成粒徑均一的微液滴。此外,纖維素濃度過高將造成微球的孔隙率較低,影響生物大分子的吸附性能。
考察了5個纖維素濃度,以纖維素:離子液體溶液為水相,葵花籽油為油相,控制合適的油相和水相流速,可以形成微液滴,固化成纖維素微球。微球經清洗和干燥后,用掃描電鏡觀察表面形貌,結果見圖;。比較發現;?纖維素濃度制備微球的球形度較好,具有典型的多孔結構,微球表面和內部孔道分布較均勻,與常用瓊脂糖凝膠的結構十分相似,故后續研究選取2%纖維素濃度。
2.2分散劑的影響
選用Span85作為油相分散劑,考察不同Span85濃度對微液滴直徑和粒徑分布的影響,結果見圖3。未添加Span85時,纖維素溶液分散不好,液滴形成不穩定,極易破裂;當Span85濃度較低,液滴大小不均勻,粒徑分布較寬;當Span85濃度在,5%-7%之間,液滴較小,粒徑分布較窄;隨Span85濃度進一步增大,微液滴粒徑和粒徑分布都有所增大。選定Span85添加量為5%-6%。
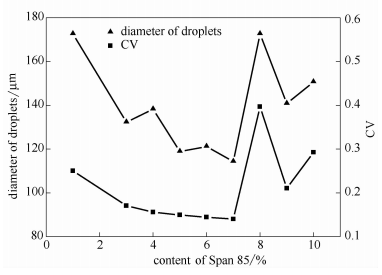
圖3 Span85添加量對微液滴粒徑和,$值的影響
2.3油水兩相流速的影響
調節合適的水相流速、油相流速以及油相)水相流速比是控制微液滴大小的有效手段。結合前期研究,固定4個油相流速和油相,考察了不同水相流速!P和油相)水相流速比對微液滴直徑和粒徑分布的影響,結果見圖4。
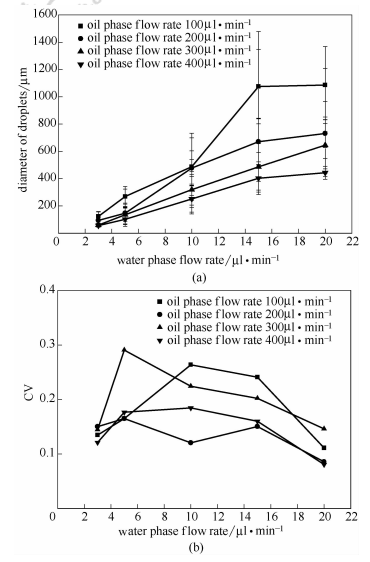
圖4油水兩相流速對微液滴粒徑和,$值的影響
從圖中可以看出,油相流速相同時,隨著水相流速增大,形成的液滴直徑也逐漸增大;在不同的油相流速下,液滴直徑增大的幅度不同,油相流速越小,液滴直徑增大越快。水相流速相同時,隨著油相流速增大,即增加油相)水相流速比,導致微液滴粒徑的減小。當水相流速為5ul*min-1時,油相流速在200-400ul*min-1。(;G3>*范圍內均可得到直徑約100ul的液滴,但是油相)水相流速比過大,過程較難控制,且造成油相浪費。比較,$值發現,基本都在0.1-0.25之間,特別是油相流速為200ul*min-1時,CV值基本在0.15以下,微液滴粒徑分布均一。
綜合考慮微液滴直徑、CV值、制備時間和成本等因素,選擇油相流速200ul*min-1,水相流速6ul*min-1為最佳條件,可形成粒徑100um左右、分布較均一的微液滴。圖5為纖維素微液滴的顯微鏡照片,可見液滴直徑分布比較均一。

圖5 纖維素微液滴的顯微鏡照片
2.4纖維素微球的理化性質
采用2%纖維素溶液為水相,添加5%Span85的葵花籽油為油相,水相流速6ul*min-1,油相流速200ul*min-1的優化條件下,十字型微通道內形成微液滴,固化成球,得到粒徑均一的纖維素微球。微球的基本性質見表1,并與商品化纖維素介質和常用瓊脂糖介質進行比較。結果表明,本文制備纖維素微球的濕真密度比略小,含水率、孔度和孔容均較大。孔度較高與制備中纖維素濃度和聚合度較低有關,較大的孔道空間有利于生物大分子的傳質分離。
纖維素微球的粒徑分布如圖6所示,體均粒徑見表1。可以看出,本文制備微球的平均粒徑與常用介質十分接近,均為100um左右。未經篩分的微球粒徑分布與商用介質相似,分布對稱性較好,體現出微通道制備粒徑均一微球的優勢。
2.5纖維素離子交換介質及其吸附性能
以纖維素微球為基質,偶聯上陰離子交換基團DEAE,得到了DEAE陰離子交換介質,命名為Cell-MC-DEAE,測得離子交換容量為123.3umol*g-1。與課題組前期用反向懸浮法制得的纖維素微球介質相比較小,也低于常用的商業化介質DEA和DEAE見表2DEAE介質對[/B的吸附等溫線如圖7所示,并以Y43=;1G2等溫式擬合吸附等溫線。由圖可見,式3可以很好地擬合實驗數據,得到的飽合吸附容量!;和解離常數、N見表2。
表1不同!PHP離子交換介質的吸附性能比較
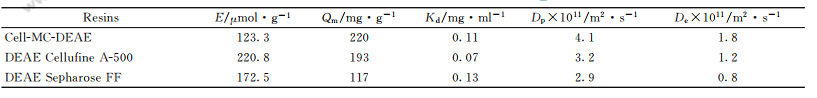
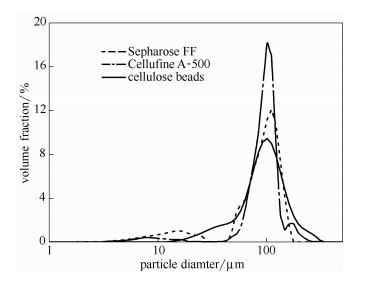
圖6 纖維素微球和商用介質的粒徑分布比較
Cell-MC-DEAE的飽合吸附容量為220mg*g-1,相比于施霏制備的介質,雖然離子交換容量較小,但吸附量較大。原因可能是施霏所用的纖維素溶液濃度高,而本文纖維素濃度僅為2%,形成纖維素微球的內部孔徑較大,生物大分子的有效吸附表面較高。圖7還比較了本文制備介質和商用介質DEAESwpharose FF、DEACell-lulineA-500的靜態吸附平衡,可以看出DEACell-luline的吸附容量較大,大約是DEAESwpharose FF介質的兩倍,略高于DEAE,6。。1QG36B:@))介質,體現出高吸附容量的特色。此外,,6。。:U,:DEAE的、N較小,即在低蛋白濃度下具有較高的吸附容量,有利于蛋白質的吸附分離。
DEAESwpharose FF介質對[/B的吸附動力學曲線如圖C所示,并與DEAE/6JL42%E655和A.:B.,6。。1QG36B:@))介質比較。采用孔擴散模型擬合吸附動力學曲線,得到孔擴散系數,J和有效擴散系數,6見表;。比較發現,雖然,6。。:U,:A.:B.介質的離子交換容量略低于DEAE/6JL42%E655,但有效擴散系數是DEAE/6JL42%E655的;倍以上;,6。。:U,:DEAE的孔擴散系數與,6。。1QG36B:@))相當。結果表明,本文制備纖維素介質具有較大孔徑,有利于生物大分子的孔內傳質和吸附分離。
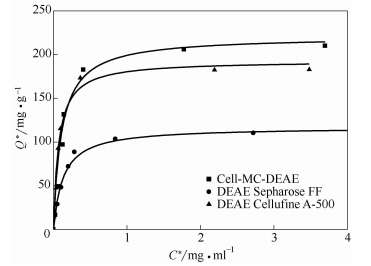
圖7 BSA吸附等溫線及與常用介質比較
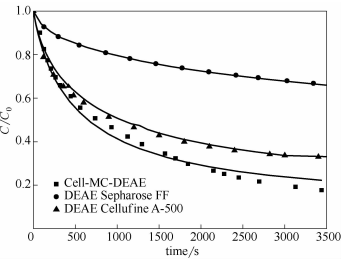
圖8不同介質的[/B吸附動力學比較
3結論
以離子液體[EMIM]MP直接溶解纖維素作為水相,在45攝氏度恒溫條件下,以十字型微通道對纖維素溶液進行分散,得到粒徑均一的纖維素微液滴,固化再生,得到纖維素微球。確定了合適的制備條件%纖維素濃度為2%,油相添加5%Span85油、水兩相流速分別為200ul*min-1和6ul*min-1,制得微球球形度好,粒徑較均一,且具有較高孔度和孔容。微球偶聯DEAE配基,制得離子交換層析介質,離子交換容量為123.3umol*g-1,飽和吸附容量Qm達220mg*g-1,有效擴散系數De為1.8*10-11m2*s-1,體現出良好的層析分離應用前景。
文獻來源化工學報DOI:10.3969/j.issn.0438-1157.2013.02.036作者:童芳麗,林東強,劉川,賀軍賢,姚善涇
(轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除)