微流控芯片電泳分離血清高密度脂蛋白亞類的研究
高密度脂蛋白(HDL)是一種由脂質和蛋白質構成的,在形狀、密度、顆粒大小、電荷和理化特性等方面都具有較大異質性的脂蛋白,它參與膽固醇逆運轉,具有抗動脈粥樣硬化(atherosclerosis,AS)作用。HDL亞類成分可以作為評估AS的危險因素,與冠心病(CHD)密切相關,但對于亞類HDL2和HDL3的相對重要性問題在臨床上一直存在分歧,國際上仍未得到統一認識,其中一重要原因是因為缺乏簡易、準確的HDL亞類分析方法。
微流控芯片電泳能夠快速高效分離分析DNA、氨基酸、蛋白質、細胞等,分離效率高、重復性好。本研究利用自制的石英芯片結合激光誘導熒光(LIF)檢測系統,在本研究組前期研究基礎上進一步改良,可簡便、高效分離出HDL亞類,并對健康體檢者和CHD患者血清標本進行分析,初步探討了微流控芯片電泳用于HDL亞類分析的臨床應用價值。
1材料和方法
1.1 標本來源
南通大學附屬醫院經冠狀動脈造影證實的CHD患者、排除心腦血管疾病及其他影響血脂代謝疾病的健康體檢者。
1.2 試劑與儀器
1.2.1 試劑。濃度為15.5g/L的HDL標準品、Tricine、甲基葡胺(MEG)、十二烷基硫酸鈉(SDS)、乙二醇、甲醇、磷鎢酸PTA)、氯化鎂(MgCl2)、溴化鉀(KBr);硝基苯并噁二唑-C6-酰基鞘胺醇(NBDC6-ceramide);沉淀劑按照中華醫學會檢驗學分會推薦的PTA-Mg沉淀法中描述配制(1.52mmol/LPTA、0.05mol/LMgCl2,pH6.1);樣品緩沖液由40mmol/LTricine、50mmol/LMEG、0.2mmol/LSDS(pH8.5)組成;分離緩沖液由40mmol/LTricine、50mmol/LMEG、0.01mmol/LSDS(pH8.5)組成。所用試劑均為分析純,配制試劑用水為二次蒸餾水,試劑配置好后均用0.22滋m的濾膜過濾。
1.2.2 儀器。LIF檢測系統(自行研制);OptimaTML-90K型超速離心機;7600-020全自動生化分析儀;CX系統電源(0~5000V)。
1.2.3 自制芯片。石英玻璃經光刻、濕法腐蝕、高溫鍵合而成,結構見圖1。整個芯片大小為64mm伊32mm,芯片微管道寬100滋m,深約25滋m,芯片樣品池到十字交叉點長4mm,有效分離長度為42mm,儲液池的直徑為2mm。樣品池1和樣品廢液池2間通道用于進樣,緩沖液池3和緩沖液廢液池4間通道用于電泳分離。

Fig.1Structureforthemicrochip(a)Chip.(b)TheSEMphotographforthecross-pointchannel.1:Samplereservoir;2:Samplewasterreservoir;3:Bufferreservoir;4:Bufferwasterreservoir.
1.3 方法
1.3.1 標本準備。受試者素食3天后,清晨空腹采血3ml,以3000r/min離心10min后分離血清,所取血清標本加入同體積沉淀劑,充分混勻,置室溫15min后3000r/min離心15min,離心后吸出上清液供測定。要求4h之內完成分離檢測,或-70℃保存。HDL標準品預處理過程:1滋lHDL標準品加入10滋l去離子水,再加入4滋l0.2g/LNBDC6-ceramide(以v(乙二醇)∶v(甲醇)=9∶1混合液預先溶解)避光預染1min,最后加入60滋l樣品緩沖液。血清標本預處理過程:6滋l預測血清加入2滋l去離子水,再加入4滋l0.2g/LNBDC6-ceramide避光預染1min,最后加入20滋l樣品緩沖液。
1.3.2 電泳過程。在芯片樣品廢液池、緩沖液池、緩沖液廢液池中加入分離緩沖液,并使通道內充滿分離緩沖液。在樣品池中加入樣品,使激光束聚焦于芯片分離通道下檢測點處。按下列程序分別向4個儲液池施加電壓,進行進樣和分離操作:進樣45s,樣品池、樣品廢液池、緩沖液池、緩沖液廢液池分別施加760V、0V、300V和450V電壓;分離4min,樣品池、樣品廢液池、緩沖液池、緩沖液廢液池分別施加500V、500V、3500V和0V電壓。運行溫度25℃,分離電場強度為450V/cm.
1.3.3 電泳原理。石英芯片微通道表面在緩沖液是堿性的情況下,硅羥基解離產生負電荷,緩沖液中陽離子在芯片管壁負電荷表面形成一圓筒形的陽離子鞘,在外加電場作用下,攜帶溶劑一齊向陰極遷移,便形成電滲流。管道中HDL亞類的遷移速度是外加電場、溶劑阻力與電滲流作用的結果,由于電滲流的作用通常大于帶電粒子所受電場力作用,所以樣品粒子在管道進行與電滲流方向一致的差速遷移。最后通過末端檢測器的檢測并記錄得到電泳圖譜。
1.3.4 統計分析。采用SPSS11.0軟件進行統計學處理,數據用x依s表達。組間差異比較使用方差分析,P<0.05有顯著性差異。
2結果
2.1HDL亞類的峰型鑒定
HDL標準品的電泳圖譜見圖2,HDL被分為2個區帶(a,b區帶),其出峰時間分別為1.5min和1.8min,4min內完成分離。根據Havel等[10]報道的超速離心法制備HDL2和HDL3,HDL2加入到分析樣品中b區帶明顯增高、面積增大,見圖3;HDL3加入到分析樣品中a區帶明顯增寬、面積增大,見圖4。可以判定快速遷移峰a為HDL3,慢速遷移峰b為HDL2。
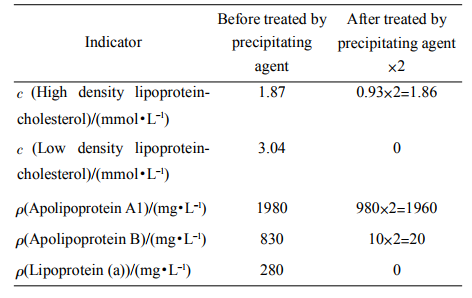
2.2沉淀劑處理前后血脂水平的測定
表1為隨機選取一健康體檢者血清標本,生化分析儀測得的沉淀劑處理前后血脂水平。沉淀劑處理后血清被2倍稀釋,所以處理后測得指標乘以2。
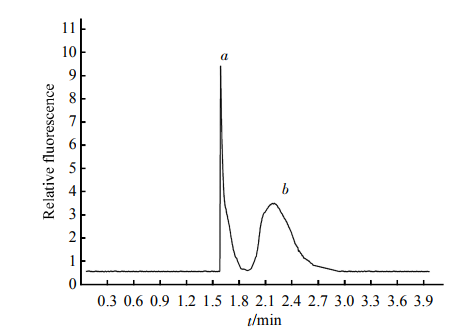
Fig.2EletropherogramoftheseparationofstandardHDLTheinjectionconcentrationofHDLwas80滋mol/L.Separationconditions:Samplebuffersolutioncontained0.2mmol/LSDS,40mmol/LTricine,50mmol/LMEGatpH8.5.Separationbuffersolutioncontained0.01mmol/LSDS,40mmol/LTricine,50mmol/LMEGatpH8.5,withEat450V/cm.
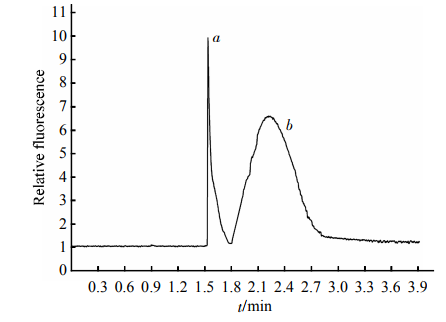
Fig.3EletropherogramofthemixturesofstandardHDLand2滋gHDL2SeparationconditionswerethesameasdescribedinFigure2.
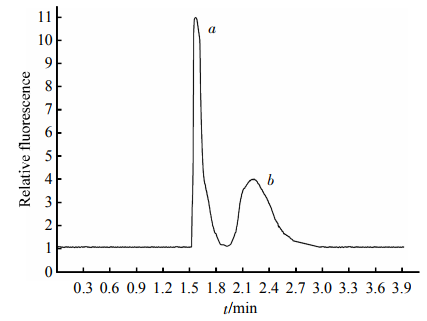
Fig.4EletropherogramofthemixturesofstandardHDLand2滋gHDL3SeparationconditionswerethesameasdescribedinFigure2.
Table1Theserumlipidlevelsofhealthysubjectsbeforeandaftertheserumtreatedbyprecipitatingagent
2.3臨床血清HDL的分析
圖5、圖6分別為健康體檢者和CHD患者血清標本連續3次電泳分離結果。全自動生化分析儀測得HDL-C濃度分別為1.78mmol/L和0.56mmol/L.
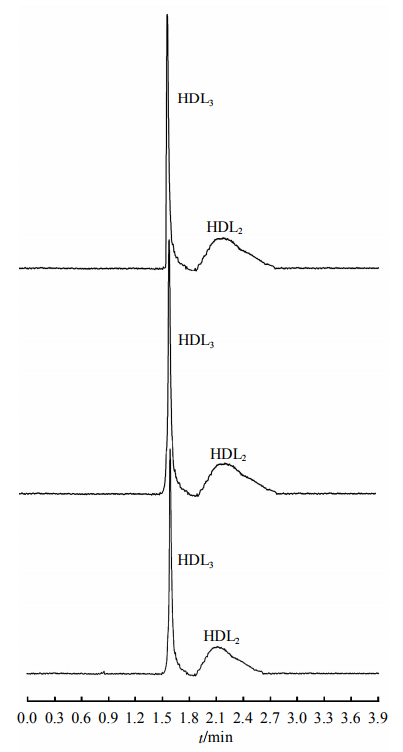
Fig.5EletropherogramsofthehealthysubjectanditsreproducibilitySeparationconditionswerethesameasdescribedinFigure2.
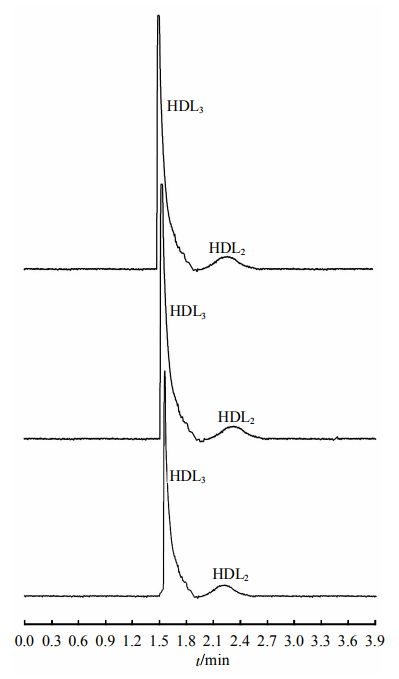
Fig.6EletropherogramsofthepatientwithCHDanditsreproducibilitySeparationconditionswerethesameasdescribedinFigure2.
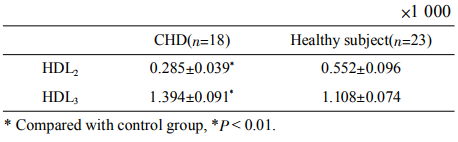
2.4CHD患者與健康體檢者HDL亞類的峰面積
表2為受試標本HDL2、HDL3峰面積的統計學結果,可見CHD患者HDL2(P<0.001)峰面積顯著低于健康體檢者組,CHD患者HDL3(P<0.001)峰面積顯著高于健康體檢者組,提示CHD患者HDL2有減少趨勢,HDL3有增多趨勢。
Table2PeakareaofserumHDLsubclasses
3討論
微流控芯片電泳可方便實現小體積(nl)進樣、分離等操作,還可在分離時施加常規毛細管電泳難以達到的高場強,能達到快速、高效分離。微流控芯片電泳用于血清脂蛋白的分離分析是由Weiller等于2002年首次報道的,本研究組前期也有過基于微流控芯片電泳技術,利用自制的微芯片結合LIF檢測系統3min內分離血清HDL、低密度脂蛋白和極低密度脂蛋白[6]的相關報道,重復性和穩定性均較好。
HDL是由脂質(磷脂和游離膽固醇位于顆粒表面,膽固醇酯和三酰甘油位于核心)和蛋白質(載脂蛋白和多種少量其他蛋白質)組成的復雜大分子.HDL不同亞類可以根據其密度、顆粒大小、電荷及組成不同進行分離,分析方法主要有超速離心法、梯度凝膠電泳法、質子核磁共振光譜法、免疫親和層析法、雙向電泳-免疫印跡法等,但這些方法多半費時耗力,技術要求高,無法在臨床上推廣應用。
本研究主要以微流控芯片電泳技術為平臺,結合LIF檢測系統,構建檢測血清HDL亞類的方法。研究中首先優化了實驗條件。Tricine、MEG緩沖液具有較寬的pH范圍,在電泳過程中能夠保持穩定的電滲流,使結果具有良好的重復性。MEG還具有動態涂層作用,能部分消除管壁對蛋白質的吸附。我們考察了MEG濃度對實驗結果的影響,最后發現MEG濃度為50mmol/L,Tricine濃度為40mmol/L時,HDL得到了最佳分離效果。脂蛋白顆粒在堿性溶液中帶負電荷,電泳過程中,荷質比不同的脂蛋白組分在電滲流的驅動下實現分離,在極端pH時有利于電滲流,但同時極端pH易使蛋白質變性,影響檢測結果。我們對緩沖液pH進行優化,分別考察了pH值為7.8、8.0、8.2、8.5、8.8、9.2、9.8時HDL亞類的分離效果。最后發現,pH為8.5時,HDL分離效率最高。蛋白質吸附會嚴重影響分離效率和重復性,SDS是一種陰離子型表面活性劑,Ceriotti等[12]通過激光散射分析實驗證實,樣品溶液中存在低濃度的SDS時不會引起脂蛋白顆粒結構的改變,我們分別在樣品緩沖液和分離緩沖液中添加了0.2mmol/L和0.01mmol/LSDS,有效提高了分離效率和分離度。
實驗中使用的沉淀劑按照中華醫學會檢驗學分會推薦的PTA-Mg沉淀法中描述配制,原理是利用沉淀劑中大分子多陰離子化合物(磷鎢酸鹽)與兩價陽離子(鎂離子)沉淀血清中乳糜微粒、低密度脂蛋白、極低密度脂蛋白和脂蛋白(a),離心后上清液中只含有HDL一種脂蛋白。由表1可知,代表Table2PeakareaofserumHDLsubclassesCHD(n=18)Healthysubject(n=23)HDL20.285依0.039*0.552依0.096HDL31.394依0.091*1.108依0.074HDL3HDL2HDL3HDL2HDL3HDL20.30.60.91.21.51.82.12.42.73.03.33.63.9t/min0.0伊1000··221生物化學與生物物理進展Prog.Biochem.Biophys.2010;37(2)HDL的指標HDL-C和載脂蛋白A1在沉淀劑處理前后幾乎不變,而代表低密度脂蛋白、極低密度脂蛋白和脂蛋白(a)的另3個指標都近似0,由此斷定離心后上清液中只含有HDL一種脂蛋白。本實驗中使用的熒光染料NBDC6-ceramide是一種能與脂蛋白顆粒特異性結合的染料,不受血清中其他物質干擾。
圖5、圖6分別為健康體檢者和CHD患者血清HDL連續3次進樣電泳圖譜,HDL3和HDL2峰均得到基線分離,且重現性良好,圖5、圖6中HDL2峰的出峰時間和峰面積相對標準偏差分別為2.76%、2.92%和2.85%、2.93%,HDL3峰的出峰時間和峰面積相對標準偏差分別為2.15%、2.24%和2.17%、2.31%。表2為18例CHD患者血清標本和23例健康體檢者血清標本的HDL亞類峰面積統計結果。可見,CHD患者HDL2顯著降低(P<0.01),HDL3顯著升高(P<0.01),可能是因為CHD患者逆向轉運膽固醇的能力降低,新生的HDL3較難轉變為成熟的HDL。在后續實驗中,我們將進一步優化方法學,并選擇合適的內標,爭取快速簡便完成定量測定。
綜上所述,本研究以微流控芯片電泳技術為平臺,結合LIF檢測系統,HDL亞類在4min內達到高效分離,重復性較佳,測試費用低廉,彌補了傳統檢測方法費時、繁瑣等不足,具有較大的推廣價值。
文獻來源生物化學與生物物理進展DOI:10.3724/SP.J.1206.2009.00506作者:鄭慧斐叢輝王惠民(轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除)