基于微流控技術實現嚴格厭氧條件下的細菌單細胞培養與實時觀測(下)
2.2.4 單細胞實驗
(1)細菌培養與預處理
在厭氧箱內進行平板劃線,挑選 5 個單菌落于 3 mL 液體培養基內進行活化過夜,過夜培養所得的菌液與培養基按 1∶100 轉接至 120 mL培養基培養至對數后期。用封膜封住離心管口后,將菌液以 5 000 r/min 離心 10 min。倒出上清液,重懸沉淀再次離心,以 5 000 r/min 離心5 min。使用含 0.01 g/mL F-127 的上清液重懸菌體,渦旋混勻。其中,固體培養基為 LB 瓊脂(E. coli)和 BHI 瓊脂(B. fragilis),液體培養基為RDM+glucose (E. coli)和 BHIS (B. fragilis)。
(2)細菌裝載
將混勻的濃縮菌液注入芯片,采用無塵膠帶貼上芯片出入口,將芯片固定在培養皿內,封膜,以 2 000~2 500 r/min 離心 5 min。在厭氧工作站內將芯片固定于自制厭氧培養盒內,密封好后架設到顯微鏡上,連接氣路和液路。
(3)單細胞延時拍攝
待厭氧盒內氧氣指示劑保持粉色,使用 100×油鏡觀察熒光場——若無可見熒光激發(E. coli),則開始選點進行延時拍攝。實驗完成后,使用自主研發的相關軟件進行圖像處理與數據分析。
3 實驗結果
3.1 厭氧程度評估
本實驗體系的關鍵點在于單細胞培養時厭氧條件的維持,這里從培養氣體氛圍與細胞學水平證據(熒光蛋白激發)來進行評估。
3.1.1 氣體氛圍
厭氧培養盒在實驗中會持續通入厭氧混合氣——95% N2+5% CO2,以營造并長期維持盒內厭氧環境。其中,N2 為模擬空氣主要成分,生理意義不大,一定濃度的 CO2 為細菌正常生長所必需。該氣體組成與常用的厭氧工作站基本相同,只是缺少 H2,而 H2 在厭氧工作站的主要作用是便于在催化裝置的作用下與 O2 反應生成H2O 以達到除氧的目的,但由于厭氧培養盒并不像厭氧工作站一樣體積巨大,需要時常取放實驗物品或者進行實驗操作而出現 O2 進入的風險;反之,厭氧培養盒具有優秀的氣密性,并且在整個厭氧培養實驗中一直維持密封,整體組裝也在厭氧工作站內進行,故無需除氧。
實驗中,厭氧培養盒內放置有氧氣指示劑,當盒內氣體氛圍達到厭氧狀態時,氧氣指示劑會維持粉色(圖 2),表明此時厭氧培養盒內氣體中O2 濃度低于檢測下限(≤0.1%)。這種狀態會在厭氧盒密封并持續通入厭氧混合氣時長期維持,只有在實驗中切換所通入的氣體,將厭氧混合氣換成壓縮空氣時,指示劑才會較快地變為藍紫色(超過檢測上限 0.5%),表明厭氧培養盒內氣體中的氧氣濃度迅速提升至與空氣相同。

圖 2 培養 48 h 后厭氧培養裝置內氧氣指示劑
3.1.2 細胞水平
在細胞學水平,本實驗采用熒光蛋白作為嚴格厭氧指示劑。熒光蛋白基因位于細菌染色體上,屬于組成型表達基因,這意味著熒光蛋白在穩態生長的細菌細胞中始終處于動態平衡狀態。而作為常規的熒光蛋白,其成熟發光除了特定光激發之外,還有一個基礎條件就是氧氣的存在,除非是特定改造專門適用于厭氧環境激發的熒光蛋白。
如圖 3(d)所示,在有氧培養下,微流控芯片中細菌細胞表達的熒光蛋白受激發產生明顯的熒光;而在厭氧培養下,雖然對明場延時拍攝圖片的分析表明細菌細胞生長狀態穩定(圖 4(b),左半部分),但是細胞中的熒光蛋白在相應波長激發光激發下,并無明顯的可見熒光產生(圖 3(b),LUTs 打開增強敏感度,故視野并非黑白),說明此時細胞內氧氣濃度不足以保證熒光蛋白成熟而受激發光。Hansen 等研究表明,1×10-7 濃度的溶解氧足以使熒光蛋白受激發產生熒光,而2.5×10-8 濃度的溶解氧則不足以支持熒光蛋白受激發而發光。本實驗結果表明,在厭氧培養盒持續通入厭氧混合氣進行厭氧培養時,微流控芯片內溶解氧濃度至少低于 1×10-7,達到了優秀的嚴格厭氧程度,完全滿足兼性厭氧菌與嚴格厭氧菌的厭氧培養,實際上 0.1% 的氧氣組成已不會對一些嚴格厭氧菌的正常生長產生影響。

圖 3 大腸桿菌厭氧及有氧條件下明場相差及對應熒光場圖像
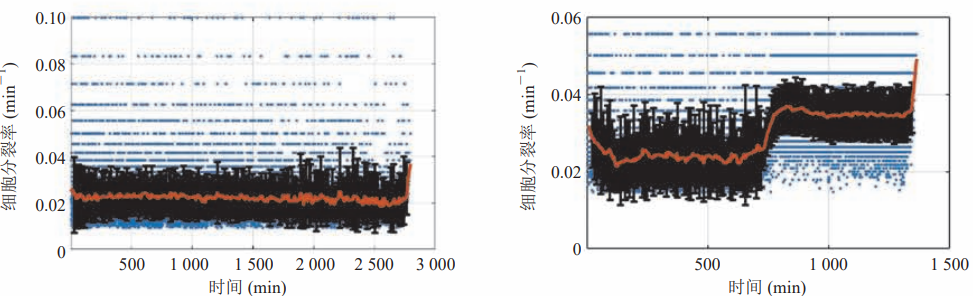
圖 4 芯片內細菌細胞在嚴格厭氧條件下穩定生長與分裂
3.2 細菌單細胞穩定生長
在單細胞實驗完成后,采用自主研發的分析程序進行圖像分析與數據處理。通過對大量單細胞的生長速率進行分析可知(圖 4):對于嚴格厭氧菌(B. fragilis),此實驗方法可以保證其長期穩定地進行生長與分裂;對于兼性厭氧菌 (E. coli),此實驗方法既可以提供厭氧環境確保厭氧穩定生長,又可以將通入的厭氧混合氣改為空氣使其實現常氧生長。
4 結果與討論
當下對細菌生理學的研究越來越關注單細胞的細胞異質性,如細菌群體中基因回路的動態表達、細胞生理狀態對抗生素的敏感性、對細菌耐藥性產生過程中起重要作用的持留性細胞等。除了方興未艾的微生物單細胞基因組和轉錄組研究外,往往僅采用傳統的群體分批培養方法,而這在研究的時空“分辨率”上是遠遠不夠的。基于微流控芯片的單細胞技術為研究細胞異質性提供了可能,這些方法中比較重要的一大類就是基于高分辨率顯微鏡的延時拍攝技術。對于在常氧條件下進行常規細菌培養,已經有許多相關培養方法,包括基于瓊脂糖平板培養、基于微流控芯片培養等,其中后者能夠在保證穩定生長分裂前提下,實現上百代細菌的單細胞譜系追蹤,但對于厭氧條件下的單細菌長期培養的研究甚少。
厭氧菌在自然界廣泛存在,而且人體腸道本就是一種厭氧環境。現在普遍認為腸道微生物對人類的健康具有很大的影響,如瘧疾、肥胖、糖尿病、癌癥的免疫應答、神經(腦腸軸)等,甚至有望基于腸道微生物進行個性化醫療。基于此,在進行單細胞實驗時,需要考慮到厭氧這一條件對細菌細胞生理的影響。針對以上需求,需要開發一種對培養環境氧氣氛圍有著嚴格控制的實驗裝置。無論是瓊脂糖平板培養還是微流控芯片培養,在不需要控制氧氣組成比例的前提下,所需實驗空間都不大,可以便捷地與商業化顯微鏡標本夾相結合使用。但是,目前商業顯微鏡移動平臺與細胞培養裝置并不能營造厭氧環境,因為這需要額外提供具有優秀氣密性的培養裝置。這種裝置需能夠同時容納單細胞培養微環境與液體培養基,在裝置外還需要相應的氣體調節與維持系統,最后為了方便實驗數據的實時采集、提高數據可信度、降低實驗復雜性、提高方法通用性,往往需要在設計時就考慮到培養裝置與顯微成像系統的合理適配。
目前涉及到厭氧條件的細菌單細胞方法的相關報道并不多,尤其是能夠直接與顯微延時拍攝相結合的方法只有基于原有設計——在瓊脂糖平板外添加密封裝置并通入厭氧混合氣,以此實現對一種厭氧的脫硫弧菌(Desulfovibrio Vulgaris Hildenborough)的培養。此外,借此研究了可逆的低濃度氧氣暴露對細胞分裂的影響。此方法由于是固體平板培養,存在營養消耗的影響,難以完美地保持穩定生長,而且所采集的數據量較少、難以追蹤單細胞譜系。雖如文中所述,培養時細菌細胞內熒光蛋白無法受激發發出熒光,以此論證其實驗裝置的厭氧程度,但是針對“無熒光”這一關鍵要素并未提供實驗結果支持。而實際上有研究表明,培養氣體氛圍中 0.1% 的氧氣就足以滿足熒光蛋白受激發光所需,在此氧氣濃度下即便是嚴格厭氧菌,由于其對氧氣有一定的耐受性,也可正常生長,故僅有嚴格厭氧菌生長的實驗結果并不能說明其實驗裝置厭氧程度很高。
本文所描述的細菌單細胞實時觀測系統主要創新之處在于使用了一種自主設計的厭氧培養裝置。它是由 3D 打印和數控機床加工而來,內部承載微流控芯片和液體培養基,進行組裝密封后,具有優異的氣密性:氧氣指示劑達到測量下限(0.1%),而細菌內熒光蛋白受激發無明顯可見亮光,進一步證明細胞培養基中溶解氧濃度低于1×10-7。該裝置可以適配商業化顯微鏡的適配器,又與氣體調節系統相連,后者為裝置內部持續通入厭氧氣體,在負壓的驅動下,新鮮液體培養基持續不斷地為細菌細胞提供營養,最終能夠確保芯片內所培養的細菌細胞在長期穩定的嚴格厭氧環境下進行生長與分裂(前提是細菌本身能夠在厭氧環境下生長)。本文所開發的實驗裝置及相應的整套實驗流程為嚴格厭氧條件下的細菌生理學研究提供了有力的技術支持。同時,由于整個實驗裝置出色的氣密性,除了嚴格厭氧微生物培養,還可以定量化探究不同氣體組成對特定微生物生長的影響。但本實驗系統目前只能使用單一培養基進行微生物培養,尚不能滿足一些需要切換培養基的特殊實驗需求,希望未來的研究能對此進行優化。
免責聲明:文章來源中國科學報 以傳播知識、有益學習和研究為宗旨。 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。
標簽: 微流控芯片