液體活檢進化史
組織活檢是目前癌癥診斷的金標準,但是具有創傷性且多次活檢患者依從性差,而液體活檢無創且可以實時監測成為了檢驗科新的趨勢。那么什么是液體活檢?其是指循環腫瘤細胞,循環腫瘤DNA和外泌體。通過非侵入性的取樣方法獲得腫瘤細胞信息,輔助腫瘤治療的突破性檢測技術。而本文重點介紹當前熱門的CTCs和ctDNA檢測技術的進展。

1. CTCs檢測技術的進展
1869年,Ashworth首次提出循環腫瘤細胞(CTCs)——原發灶或轉移灶脫落進入外周血的腫瘤細胞,其包含有原發性腫瘤的遺傳信息和表型。
CTCs在血液中的含量極少,因此對其進行研究時必須先進行富集。富集方法主要包括梯度離心法、過濾法和免疫磁性分選法。檢測方法包括免疫學技術、反轉錄聚合酶連鎖反應技術、酶聯免疫斑點技術以及CTC 芯片技術。
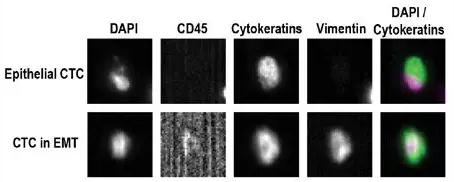
圖1. CellSearch 檢測CTCs代表性例子的結果示意圖
其中免疫磁性分選法是當前最常用的一種CTC富集方法。而強生公司研發的專有技術CellSearch檢測系統(圖1)已經成為CTC檢測的一個標準實驗方案,特異度達到80%。通過上皮細胞黏附因子標記的抗體磁珠來捕獲CTC,然后細胞內角質蛋白熒光抗體(CKPE)可以識別上皮細胞,白細胞熒光抗體(CD45-APC)能夠識別白細胞以及4',6-二脒基-2-苯基吲哚(DAPI),熒光核染料用于生成顯微鏡下可視細胞圖像。其中符合腫瘤細胞學形態特征而同時CKPE (+)、DAPI (+) 和CD45(-)的細胞被定義為CTC。該方法只需要7.5ml血液樣本,即可從幾百億血液細胞中檢測到一個CTC。 CellSearch 檢測系統目前也已經被FDA批準進入臨床應用。
2.ctDNA檢測技術的進展
1940年Mandel和Metais首次提出了細胞外游離核酸(ctDNA),其主要來源于凋亡或壞死的腫瘤細胞的DNA片段,隨著人體血液循環系統不斷的流動,并攜帶有基因突變、缺失、重排、拷貝數異常和甲基化等信息。但是ctDNA在腫瘤患者體內的含量很低,約占整體cfDNA 的1%,半衰期短,約為2h。因此需要靈敏度高的檢測技術。
ctDNA 檢測技術可分為兩個階段。第一階段為基于PCR 技術的檢測技術,如突變擴增阻滯系統(ARMS) 法、直接測序法( Sanger法)、微滴數字化PCR(dPCR) 等。第二階段為在NGS 基礎上發展起來的檢測方法。
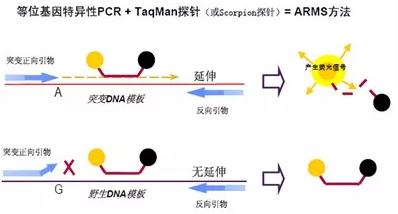
圖2. ARMS法
ARMS法(圖2)的原理是PCR引物的3'端末位堿基必須與其模板DNA互補才能進行擴增,需要設計等位基因特異性PCR擴增引物,只有在引物3'堿基與模板配對時才能出現PCR擴增帶,從而檢測出目的基因是否突變。以提取到的ctDNA作為模板可用于檢測是否發生特定的基因突變。例如,用人類EGFR基因突變檢測試劑盒檢測EGFR基因是否發生突變。當EGFR基因為野生型時,一般情況下無法延伸,只有當EGFR基因發生突變時引物可與模板完全匹配,隨即發生相應的擴增。若EGFR基因未發生突變則無擴增。
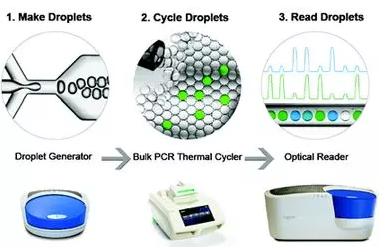
數字PCR (dPCR)(圖3)是將一個標準的PCR反應分配到大量微小的反應器中,在每個反應器中包含或不包含一個或多個拷貝的目標分子( ctDNA作為模板),實現單個反應器單條模板的PCR擴增,擴增結束后,通過陽性反應器的數目計算目標序列的拷貝數,是一種DNA定量的新技術。優點是可以對ctDNA進行絕對定量,靈敏度可達到單個核酸分子,檢測限低至0.001%,但缺點是只能檢測已知的突變位點且通量低。
二代測序法是利用測序儀器來捕捉新滲入的末端熒光標記來確定DNA序列的組成,能一次并行對幾十萬到幾百萬條DNA分子進行序列測定。同樣可以將提取到的ctDNA用其進行檢測。不僅可以檢測已知基因變異,更重要的是可以進行全基因組范圍內的基因變異分析,包括基因突變、重排以及基因組拷貝數變異(CNV),并可以發現未知的基因變異。