液滴微流控芯片系統中微液滴特性表征及氨基酸檢
微生物是工業生物技術的核心與基礎。利用先進的現代自動化和儀器分析技術開發的高通量篩選平臺,具有自動化、標準化、高通量化等特征,大大突破了人工篩選在速度、效率和標準化等方面的限制,是微生物菌種篩選的一次技術革命。然而,已經投入使用的各類高通量篩選系統主要是由國外公司開發的價值昂貴、操作復雜的大型裝備系統,其普適性受到較大的限制。因此,開發操作簡單、成本相對不高的高通量篩選系統是重要的發展方向,特別是近年來基于微流控芯片的檢測和篩選系統更是受到極大的關注。
微流控芯片系統(Microfluidics)或微流控芯片實驗室,是將化學和生物等領域中所涉及的樣品制備、反應、分離、檢測及細胞培養、分選和裂解等基本操作單元集成到幾個平方厘米(甚至更小)的芯片上,由微通道形成網絡,由可控流體貫穿整個系統。目前的微流控芯片系統主要包括連續微流體系統和液滴微流體系統。基于連續微流體的微流控芯片系統研究較多,已經成功應用在蛋白和核酸的電泳分析上,并有商品化的分析儀。相對于連續微流體系統,基于液滴微流體的微流控芯片系統最大的優勢在于可以形成獨立的單個微液滴反應器,可以據此對分析樣品進行單獨包埋并在相互分開、互不干擾的微液滴小室中進行檢測分析,使得檢測和篩選細胞或其胞外分泌產物成為可能。該系統具有速度快、通量高、成本低等顯著特點,對開展定向進化改造工程用酶,研究外分泌胞外產物(代謝產物)等相關研究領域具有重要的推動作用。
由于微生物篩選實驗通常需要較長的時間,所以對微流控芯片中的微液滴有更高的要求,如提高微液滴的穩定性,優化生物兼容性以及防止微液滴內水相物質滲漏到油相等。本研究針對以上問題,以代謝產物(氨基酸)為研究對象,通過對包埋氨基酸的皮升級微液滴特性的研究,為液滴微流控芯片系統在氨基酸檢測和相應生產菌株的高通量篩選以及定向進化改造方面奠定了基礎。
1材料與方法
1.1 材料
1.1.1 菌種
含有pET30a-mCherry的大腸桿菌EscherichiacoliBL21(DE3)菌株來由實驗室保存,該菌株可以誘導表達產生熒光蛋白mCherry,用于檢測微液滴的生物活性兼容性。
1.1.2 儀器與芯片
532nm激光器購自長春新產業光電技術有限公司;聚焦物鏡購自奧林巴斯公司;Nikon1J1高速攝像機購自Nikon公司;532nm、610nm濾光片均購自北京卓立漢光儀器有限公司;光電倍增管購自CenturianSurplus公司;PCI6070e數據采集卡購自NationalInstruments公司;MODEL609E-6高壓放大器購自Trek公司;Mitos壓力泵購自環球分析測試儀器有限公司;硅片購自上海齊鳴硅材料有限公司;SU-8 2025光膠購自美國MicroChem公司;等離子清洗機購自美國Harrick公司;勻膠機購自中國科學院微電子研究所;加熱臺購自誼華電子設備有限公司;紫外光刻機購自中國科學院光電技術研究所;微流控芯片為自制PDMS芯片,PDMS購自Momentive公司。
1.1.3 主要試劑
AbilEM90購自EvonikDegussa公司;礦物油、鈣黃綠素、Span80、CuCl2、EDTANa2均購自國藥集團化學試劑有限公司;各種氨基酸均購自Solarbio公司;IPTG(異丙基-β-D-硫代吡喃半乳糖苷)、氨基酸氧化酶和過氧化氫酶均購自Sigma公司;丙二醇甲醚醋酸酯購自阿法埃莎(天津)化學有限公司;異丙醇購自北京化工廠;熒光底物AmplexUltraRed購自Invitrogen公司。
1.2 方法
1.2.1 液滴微流控芯片整合控制系統的搭建(光路設置、數據采集和控制系統)及工作流程
如圖1所示,本液滴微流控芯片整合控制系統采用非聚焦光路。
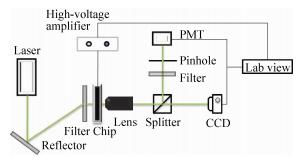
圖1液滴微流控芯片整合控制系統示意圖
激光器發出波長為532nm,發射后的激光通過濾光片除去雜波,然后聚焦到微流控芯片的檢測點。當包埋熒光物質的微液滴通過檢測點時被激發產生熒光,熒光經聚焦物鏡聚焦后到達分光鏡。通過分光鏡將一部分熒光傳給高速攝像機,實時監控微液滴的流動情況;另一部分熒光則通過濾光片,由光電倍增管(PMT)接收并將熒光信號轉化為電壓信號后,由數據采集卡采集并由LabVIEW軟件進行分析。高壓放大器用于微液滴的偏轉,當目標微液滴的檢測信號超過分選設定閾值時,分析軟件通過高壓放大器和微流控芯片上的電極對微液滴施加偏轉電壓。由于介電電泳力的作用,目標微液滴將發生偏轉,流至分選通道得到收集。
1.1.1 液滴微流控檢測分選芯片制備和微液滴生成
微流控芯片通過模塑法制備。首先根據要求利用AutoCAD軟件設計芯片圖形(圖2A)并獲得相應的光刻掩模(掩模由深圳美精微光電股份有限公司制作),然后通過光刻法將圖形轉移到芯片上。具體步驟是:首先選取潔凈的硅片,放到等離子機清洗4min,然后用勻膠機以1800r/min的轉速均勻的覆蓋一層50μm的SU-82025光膠,并在95℃下預烘30min;待其冷卻后在光刻掩模下紫外曝光20s,在95℃烘40min;將未曝光的光膠用丙二醇甲醚醋酸酯和丙三醇交替沖洗干凈,在110℃下加熱30min,即獲得所需芯片通道的陽模。芯片由目前被廣泛采用的PDMS材料制作,PDMS具有較好的透氣性、良好的透光性和生物兼容性[15-16]。將PDMS預制劑和交聯劑以10:1的比例均勻混合后,倒在制備好的陽模上,在60℃下加熱4h使其固化。揭下該含有微流通道的PDMS并與另一塊平整的PDMS封合,即得所需芯片,芯片實物如圖2B所示。微流控芯片以Mitos壓力泵作為流體動力,利用PEEK材質的塑料管將其與芯片連接,采用流動聚焦(Flow-focusing)方式在芯片內生成微液滴。
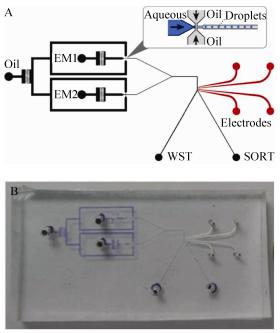
圖2微流控芯片設計示意圖(A)及實物圖(B)
1.2.3微液滴特性研究和氨基酸包埋檢測分析
利用微流控芯片生成油包水(w/o)的微液滴,通過包埋含有pET30a-mCherry的E.coli細胞并檢測不同時間點熒光蛋白的表達量,測定由不同表面活性劑組成的微液滴對細胞活性的影響作用。根據微液滴的形態學檢測,對生成的微液滴的穩定性進行研究。參照Kendall等研究方法[19-20]對微液滴的分子擴散情況進行研究。
氨基酸的熒光檢測采用雙酶偶聯法。以谷氨酸與熒光底物AmplexUltraRed反應后的混合體系作為水相,以添加非離子型表面活性劑的礦物油為油相,生成包埋氨基酸反應體系的皮升體積微液滴,并對微液滴進行在線的熒光檢測和篩選。通過類似方法對苯丙氨酸、色氨酸和酪氨酸也進行了檢測。
2結果與分析
2.1微液滴的生成
如圖3所示,利用流動聚焦(Flowfocusing)方式生成微液滴,通過改變油、水兩相的流速可獲得理想大小的微液滴。
實驗結果顯示,自行設計的芯片生成的微液滴具有良好的單分散性(微液滴間相互獨立)和均一性,微液滴直徑可控制在20?50?m范圍內,生成速度每分鐘600?1200個。

圖3微液滴的生成
2.2微液滴的生物活性兼容性
油包水(w/o)微液滴作為微反應器用于細胞培育或者代謝產物的反應,都要求微液滴有較好的生物兼容性,因而油相組分,尤其是表面活性劑的選擇非常重要[11]。相對于離子型表面活性劑,非離子型表面活性劑對細胞和蛋白不造成強靜電作用力的損害,因此,具有更好的生物活性兼容性。本研究對目前使用較多的w/o非離子型表面活性劑Span80和AbilEM90進行了測定。實驗中以分別添加3%(V/V)Span80和3%(V/V)AbilEM90的礦物油作為油相,對添加IPTG的E.coliBL21(DE3)(含有pET30a-mCherry)細胞培養液進行微液滴包埋,并對微液滴進行37℃靜置培養。通過測定不同時間點微液滴的熒光值(Ex/Em:490nm/585nm)來反映微液滴內的細胞蛋白生物表達量。如圖4所示,添加表面活性劑AbilEM90的礦物油包埋的E.coli細胞具有更高的熒光蛋白表達量,表面活性劑AbilEM90比Span80有更好的生物兼容性(圖4)。故本實驗最終選擇含3%(V/V)AbilEM90的礦物油作為油相。
2.3微液滴的穩定性
微液滴需要在一定時間內保持穩定存在,從而為其檢測篩選提供基礎。因此,穩定性是微液滴的重要指標。本實驗將谷氨酸等4種氨基酸分別進行微液滴包埋,對生成的微液滴在離線條件下室溫培養,利用顯微照相系統觀察不同時間點微液滴的穩定狀態。實驗結果表明,微液滴室溫培養20h后形態仍然保持穩定(圖5)。對比培養前,98%的微液滴無融合和破裂,可以有效滿足細胞產生相關熒光信號檢測的要求。
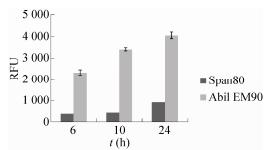
圖4表面活性劑對微液滴內細胞活性的影響
2.4微液滴的分子擴散
在培養過程中,如果微液滴內包埋的水相物質擴散到液滴外,并進入到另外一個微液滴內,必然影響檢測和分選的效率,所以微液滴間低分子擴散與否非常重要。好的微液滴應該是包埋物質既沒有滲透到微液滴外,也沒有在液滴間發生交叉污染。擴散性是微液滴作為互不干擾的獨立微反應器的重要指標。參照Kendall等人提出的方法對微液滴分子擴散情況進行了檢驗。
采用含3%(V/V)AbilEM90的礦物油作為油相,5mmol/L鈣黃綠素、10mmol/LCuCl2、0.1mmol/L谷氨酸混合液作為水相1,乳化成的微液滴為E1;50mmol/LEDTANa2作為水相2,乳化成的微液滴為E2;水相1和水相2以體積比15混合作為水相3,乳化成的微液滴為E3;微液滴E1和微液滴E2以體積比15混合為微液滴ME,測定4種微液滴在不同時間點的熒光值(Ex/Em:490nm/515nm)。結果表明,室溫培養20h后,微液滴ME的熒光值幾乎沒有變化,微液滴間的分子交換<2%,對微液滴的檢測和分選影響可以忽略(圖6)。因此,選擇含3%(V/V)AbilEM90的礦物油作為油相生成的微液滴內物質無明顯的分子擴散,可作為微反應體系。

圖5微液滴穩定性
2.5氨基酸包埋微液滴的檢測與分選
在上述研究基礎上,利用搭建的液滴微流控芯片系統對氨基酸進行了檢測與分選。實驗以兩種濃度的谷氨酸(10?mol/L和20?mol/L)為檢測對象,通過液滴包埋,在圖2所示的芯片中生成含有兩種谷氨酸濃度的微液滴,生成速度為每分鐘600個。
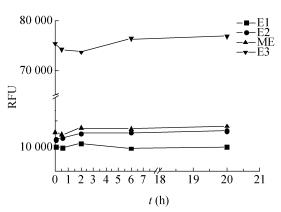
圖6微液滴間的分子交換
兩種不同濃度氨基酸包埋微液滴的熒光檢測信號如圖7所示。其中,包埋20?mol/L谷氨酸的微液滴熒光值高于設定的閥值,軟件自動給出信號到高壓放大器,產生偏轉電壓使微液滴受介電力作用偏轉至“SORT”孔道,微液滴被分選,而包埋10?mol/L谷氨酸的微液滴不會被分選,流向“WST”孔道。實驗結果表明,本研究設計的液滴微流控芯片系統具有氨基酸檢測與分選功能,檢測分選通量可達到每分鐘600個。
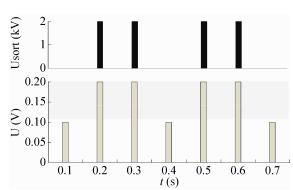
圖7谷氨酸微液滴的熒光檢測與分選
3總結
液滴微流控芯片的優勢在于可以形成相互獨立無干擾的單個微液滴反應器,如果將每一個微液滴看成一個微反應器或者細胞培養器進行高通量的檢測與分選,將為研究外分泌胞外產物(代謝產物)及其工程菌株的定向進化提供強有力的篩選平臺。
本研究搭建的液滴微流控芯片高通量篩選平臺具有設計簡單、操作方便等特點。利用該平臺進行了包埋氨基酸的微液滴的生成、微液滴特性研究和熒光檢測與分選實驗。實驗結果表明:1)生成的微液滴直徑可控,大小均一、穩定,微液滴內反應體系小,可節省大量試劑;2)微液滴可以長時間穩定存在,滿足試劑反應或細胞培養對時間的要求;3)微液滴的包埋物在測試微液滴中穩定存在,微液滴間無交叉污染,不會對后期微液滴的熒光檢測和分選產生影響;4)微液滴的篩選通量可達每分鐘600個。這些實驗為酶及氨基酸等細胞分泌物的檢測分析和相應生產菌株的篩選提供了高通量篩選的可能,對液滴微流控芯片在定向進化方面的應用奠定了基礎。
文獻鏈接:
DOI: 10.13345/j.cjb.130361
(文章來源:生物工程學報 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除)
標簽: 液滴微流控芯片