基于微流控芯片技術的腫瘤液體活檢新方法
譜學分析與儀器教育部重點實驗室楊朝勇教授課題組、廈門大學化學化工學院李清彪課題組以及廈門大學附屬中山醫院王效民團隊合作,提出了基于微流控芯片技術的腫瘤液體活檢新方法,相關研究結果發表在《德國應用化學》上。
循環腫瘤細胞(CTC)是從腫瘤組織脫落進入外周血的各類腫瘤細胞的總稱,是導致腫瘤轉移的關鍵因素。與經典組織活檢相比,基于CTC檢測的液體活檢技術具有腫瘤分子信息全、侵入性小、取樣方便、成本低等優勢,已成為目前最具發展潛力的腫瘤無創診斷和實時療效監測手段之一,在腫瘤分期診斷、動態監測、用藥指導和療效評估等方面具有重大意義。
CTC檢測的最大困難在于其在外周血中含量稀少,而背景干擾卻相當復雜。通常1 mL 外周血中含有10億個紅細胞,100萬個白細胞,而可能只含有1-10個CTC,在如此龐大復雜的正常細胞背景干擾下,很難實現高靈敏、高特異的CTC 捕獲檢測。
楊朝勇教授課題組針對這一挑戰性課題,發展了基于流體力學分離與免疫識別的CTC捕獲富集芯片(SDI-Chip)。該芯片內構建了成千上萬個表面修飾有抗體的微柱陣列。微柱陣列排布方式根據確定性側向位移分離原理設計,CTC因尺寸較大將沿微柱偏移方向運動并不斷與微柱碰撞而實現特異性識別捕獲,而血細胞因尺寸較小沿沿液流方向運動且很少與微柱碰撞而避免非特異性吸附。該設計有效地結合CTC在物理性質及表面標志物與背景細胞的差異,實現了CTC的高效、高純度協同捕獲。通過對大量臨床腫瘤病人外周血樣品的測試,該團隊驗證了所發展的芯片技術在腫瘤分期診斷、療效監控等方面的潛在應用價值。
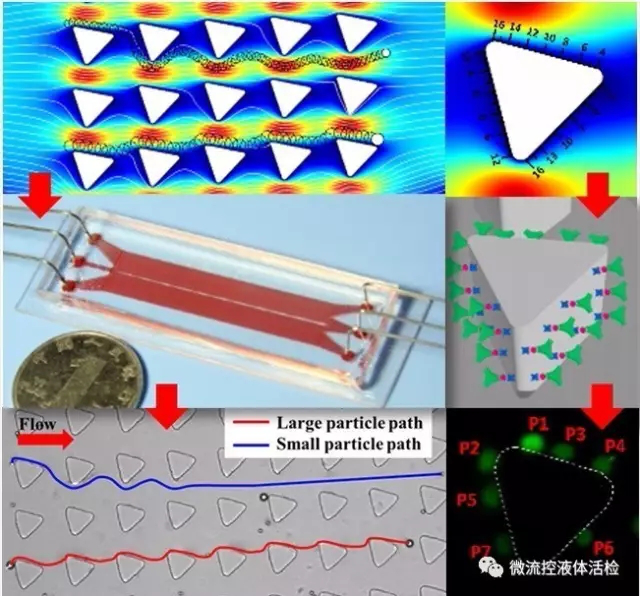
來源:Metages Gashaw Ahmed, MahletFasil Abate, Dr. Yanling Song et al. Isolation, Detection, and Antigen-BasedProfiling of Circulating Tumor Cells Using a Size-Dictated Immunocapture Chip.Angewandte Chemie, 2017.