基于非牛頓微液滴的粒子封裝及檢測(上)
作為一種將微流控芯片技術(shù)與液滴技術(shù)相結(jié)合的新興技術(shù), 液滴微流控技術(shù)具有更高的實(shí)驗(yàn)效率和更精確的操作控制能力. 液滴微流控技術(shù)可以實(shí)現(xiàn)液滴精確控制, 實(shí)現(xiàn)液滴之間的快速混合和反應(yīng), 液滴作為反應(yīng)容器, 可以容納多種物質(zhì)以及微小顆粒, 在高速流動(dòng)的微通道中可以實(shí)現(xiàn)高通量的分析和檢測. 液滴微流控技術(shù)可以應(yīng)用于生物醫(yī)學(xué)研究中更復(fù)雜的微觀實(shí)驗(yàn)操作和分析, 尤其是在高通量單細(xì)胞分析實(shí)驗(yàn)和材料合成等相關(guān)應(yīng)用中承擔(dān)重要角色. 單細(xì)胞的排列、分離和隔離, 藥物與細(xì)胞的共封裝, 是液滴微流控技術(shù)應(yīng)用的關(guān)鍵步驟.
眾所周知, 微流控液滴封裝技術(shù)存在一個(gè)基本限制: 泊松限制. 懸浮在離散相中的微粒或細(xì)胞封裝過程中是隨機(jī)的接近封裝區(qū), 導(dǎo)致每個(gè)液滴中的粒子或細(xì)胞數(shù)量的不確定性, 液滴封裝粒子數(shù)量往往成正態(tài)分布, 單粒子的封裝率一般為20% ~ 35%. 泊松分布的存在限制了微流控封裝技術(shù)的進(jìn)一步發(fā)展. 近年來, 研究者嘗試開發(fā)各種各樣主動(dòng)或被動(dòng)的方法去擺脫泊松限制, 從而提高液滴封裝效率. 例如使用慣性排序以及使用激光干擾細(xì)胞封裝等. Kemna等通過設(shè)計(jì)螺旋通道引入迪恩力, 實(shí)現(xiàn)了粒子的有序排列, 從而提高封裝率. 然而, 隨著流量條件的改變, 會(huì)有多個(gè)平衡位置出現(xiàn), 不利于單粒子封裝. Harrington等設(shè)計(jì)了雙螺旋結(jié)構(gòu), 將迪恩夾帶應(yīng)用于細(xì)胞與微粒, 通過定義不同的體積比來實(shí)現(xiàn)有效共封裝, 并調(diào)節(jié)體積比縮放以確定最佳封裝條件. 螺旋結(jié)構(gòu)存在的主要問題是迪恩力會(huì)將粒子的平衡位置推向邊緣, 沿著通道邊緣運(yùn)動(dòng)的粒子在封裝區(qū)會(huì)受到液滴頭內(nèi)部流場的影響卷入通道中心, 從而影響封裝效果. Edd等在高縱橫比通道下嚴(yán)格控制粒子有序化的附加程度, 使其產(chǎn)生精確交錯(cuò)的縱向間隔的兩個(gè)液滴列, 并結(jié)合復(fù)雜的光學(xué)設(shè)備實(shí)現(xiàn)了細(xì)胞及微粒受控的高效封裝. 然而, 這種方法缺乏穩(wěn)健性且容易破壞細(xì)胞活性, 難以滿足細(xì)胞封裝的生物相容性要求.
需要指出的是, 現(xiàn)有實(shí)驗(yàn)研究大多使用牛頓流體, 而在實(shí)際生物醫(yī)學(xué)應(yīng)用中的流體介質(zhì)往往具有明顯的非牛頓性質(zhì), 如剪切稀化和黏彈性等. 與牛頓流體相比, 非牛頓性質(zhì)的引入會(huì)影響液滴生成的模態(tài). 由于流量條件以及流體性質(zhì)的不同, 常見的液滴微流控生成通道中存在5種基本的液滴生成模式: 擠壓、滴流、射、尖端流及尖端多液滴破碎模態(tài). 了解非牛頓液滴生成模態(tài)是穩(wěn)定制備高單分散性非牛頓液滴的前提條件, 而單分散性是保證液滴封裝環(huán)境均一的關(guān)鍵環(huán)節(jié). 在保證單分散液滴生成的基礎(chǔ)上, 若可實(shí)現(xiàn)粒子或細(xì)胞在離散相中有序排列, 有望大幅提高封裝效率.
在微流控平臺(tái)實(shí)現(xiàn)微粒的高效封裝之后, 封裝率的檢測也是應(yīng)用中的重要環(huán)節(jié). 傳統(tǒng)的液滴封裝率以手動(dòng)計(jì)算為主. 基于液滴微流控技術(shù)的粒子封裝具有高通量特點(diǎn), 這使得數(shù)據(jù)量較為龐大, 且液滴密集以及圖片大小和清晰度等問題無疑會(huì)為手工計(jì)算增加難度. 通過圖像處理實(shí)現(xiàn)粒子封裝率的自動(dòng)計(jì)算應(yīng)是解決之道. 現(xiàn)有算法包括卷積神經(jīng)網(wǎng)絡(luò)、YOLO和DETR等. 其中, 卷積神經(jīng)網(wǎng)絡(luò)適用于處理圖像特別是圖像識(shí)別; YOLO算法檢測速度非常快, 但對(duì)相互靠近的物體, 以及很小的群體檢測效果不好; DETR算法簡化了目標(biāo)檢測的網(wǎng)絡(luò)架構(gòu), 但需要更長的訓(xùn)練時(shí)間來收斂. 新近發(fā)展的Deformable DETR算法結(jié)合了DETR算法的圖上檢測能力, 也解決了收斂速度慢和特征空間分辨率有限的問題, 有望應(yīng)用于復(fù)雜場景下粒子的封裝率檢測.
基于上述分析, 本文旨在發(fā)展基于非牛頓微液滴的粒子封裝及檢測技術(shù). 首先, 基于流動(dòng)聚焦微通道和聚合物溶液開展非牛頓液滴生成實(shí)驗(yàn), 研究不同非牛頓液滴生成模態(tài). 其次, 選取兼具剪切稀化與彈性效應(yīng)的非牛頓流體, 結(jié)合粒子慣性-黏彈性排序, 探索不同流量條件和不同液滴生成模態(tài)下粒子封裝效率. 最后, 建立Deformable DETR粒子封裝檢測模型, 實(shí)現(xiàn)了粒子封裝的高精度檢測. 研究結(jié)果可在一定程度上拓展對(duì)于液滴微流控基礎(chǔ)理論的認(rèn)識(shí), 為優(yōu)化基于非牛頓微液滴的粒子封裝技術(shù)提供一定參考.
材料和方法
1. 流體配置
實(shí)驗(yàn)選取橄欖油作為連續(xù)相流體, 其密度和黏度分別為0.92 g/cm3和78 mPa·s; 選取3種聚合物溶液作為離散相流體, 分別為聚環(huán)氧乙烷水溶液(PEO)、聚乙烯吡咯烷酮水溶液( PVP)、黃原膠水溶液(XG). 離散相的牛頓流體對(duì)比項(xiàng)選用甘油-水混合液( GW, 60 wt.%). 所使用聚合物均配置時(shí)未做其他處理. 聚合物溶液采用回旋振蕩器以100 r/min的速率混合1 ~ 2 d; 甘油-水混合液直接按照配比質(zhì)量分?jǐn)?shù)加入去離子水, 充分搖混即可. 所有配置溶液靜置6 h以上再進(jìn)行后續(xù)實(shí)驗(yàn).
含粒子的溶液配置時(shí), 將50 mg/mL直徑為20 μm的聚苯乙烯微球(CV 3.1%, 中科雷鳴) 添加到離散相溶液中, 裝入密封容器中進(jìn)行混勻, 使用工作頻率為40 kHz, 功率為100 W的超聲清洗機(jī)對(duì)裝載粒子的離散相溶液進(jìn)行隔水超聲處理, 避免粒子聚團(tuán), 配置成粒子濃度為0.5 wt.%的離散相溶液.
2. 芯片設(shè)計(jì)與加工
圖1展示了本研究所設(shè)計(jì)的芯片結(jié)構(gòu)示意圖, 微通道的寬度(W)和深度(H)均為 100 μm. 矩形結(jié)構(gòu)盡可能減少壁面對(duì)液滴生成的影響, 并且可以基于二維圖像合理地分析液滴生成過程. 在粒子封裝過程中, 為盡可能避免粒子分布受入口切面的影響, 將入口與出口孔徑設(shè)計(jì)為800 μm. 粒子在通道中雜亂排列, 使得被封裝的粒子具有隨機(jī)性, 使粒子封裝存在基本的泊松限制, 在離散相前端通道設(shè)計(jì)蛇形通道, 蛇形通道的單程長度L1 = 4 mm, 主通道長度L = 2 cm為粒子平衡提供空間距離. 為簡化連續(xù)相輸入控制, 將兩側(cè)連續(xù)相通道在外側(cè)合并成一個(gè)主入口. 主入口的連續(xù)相和離散相的流量分別用 Qc 和 Qd表示. 可知, 連續(xù)相兩側(cè)通道流量各為Qc/2.
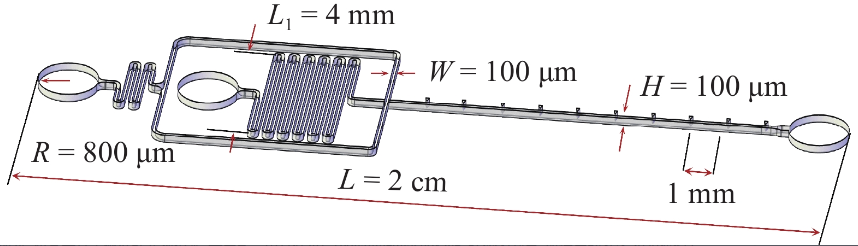
圖 1 芯片結(jié)構(gòu)示意圖及幾何參數(shù)
微流控芯片實(shí)物如圖2所示. 芯片是基于標(biāo)準(zhǔn)軟光刻技術(shù), 采用聚二甲基硅氧烷(PDMS)制備. 將PDMS與固化劑按10: 1的比例配置并使用玻璃棒攪拌, 直至混合液中充滿小氣泡, 放入真空容器中脫氣之后在掩模板上澆鑄, 在真空容器中進(jìn)行二次脫氣后放入70 °C干燥箱中烘烤2 h. 烘烤結(jié)束之后, 將固化好的PDMS模塊剝離掩模板, 使用切割器PDMS分割出所需模塊, 用外徑1 mm的打孔器在入口和出口處打孔, 然后將PDMS模塊氧等離子體鍵合到玻璃顯微鏡載玻片(25 mm × 75 mm)上, 使用聚乙烯管連接芯片入口與注射器上的25 G針頭, 連接周圍使用專用膠進(jìn)行加固.

圖 2 芯片實(shí)物圖
3. 實(shí)驗(yàn)操作及數(shù)據(jù)處理
微流控芯片固定在倒置顯微鏡載物臺(tái)上, 使用高精度流量泵驅(qū)動(dòng)兩個(gè)1 mL注射器分別將離散相和連續(xù)相流體以恒定流量通入微通道中. 兩相流體在流動(dòng)聚焦結(jié)構(gòu)處相遇, 在合適流量條件下, 連續(xù)相橄欖油剪切離散相聚合物溶液形成微液滴. 實(shí)驗(yàn)中的流量通過流量泵調(diào)節(jié), 流量參數(shù)直接讀取即可. 本實(shí)驗(yàn)的流量為Qd = 10 ~ 100 μL/h, Qc = 100 ~ 3000 μL/h. 液滴生成及粒子封裝過程通過高速相機(jī)以2000幀/秒的速度記錄. 所有實(shí)驗(yàn)均在室溫下進(jìn)行. 圖3展示了液滴檢測及封裝率計(jì)算模型. 本文驗(yàn)證了其在單液滴與多液滴場景下粒子封裝率高精度檢測的有效性, 具體過程在后續(xù)結(jié)果與討論部分詳述.
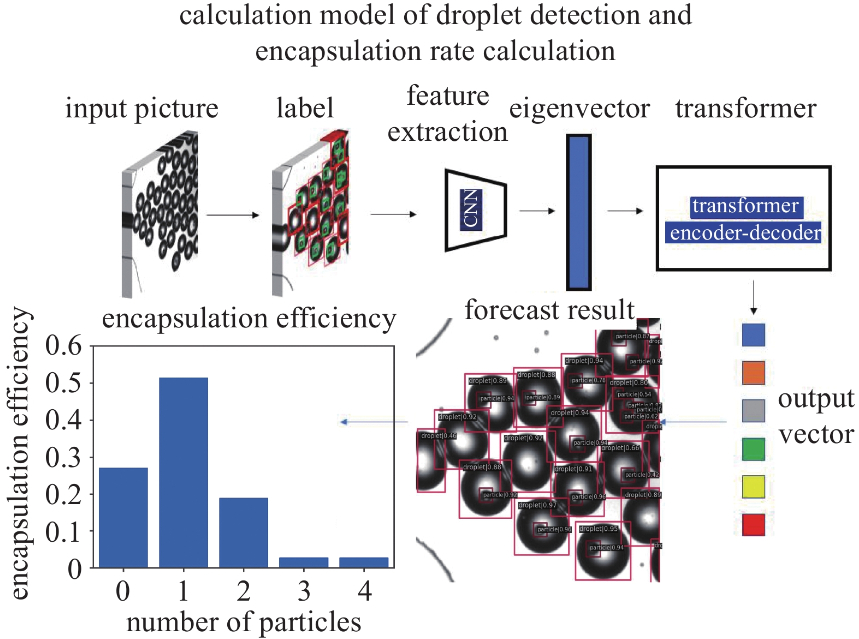
圖 3 液滴檢測及封裝率計(jì)算模型及工作流程
免責(zé)聲明:文章來源網(wǎng)絡(luò) 以傳播知識(shí)、有益學(xué)習(xí)和研究為宗旨。 轉(zhuǎn)載僅供參考學(xué)習(xí)及傳遞有用信息,版權(quán)歸原作者所有,如侵犯權(quán)益,請(qǐng)聯(lián)系刪除。
標(biāo)簽: 微流控芯片