一種力-電協同驅動的細胞微流控培養腔理論模型
摘要
細胞培養液在微流控生物反應器中受到外界物理場(如壓力梯度或者電場)作用流動而產生流體剪應力,并進一步刺激種子細胞調控其內部基因的表達,從而促進細胞的分化和生長,這個過程在自然生命組織內的微管中亦是如此。考慮到細胞培養微腔隙中液體流動行為很難實驗量化測定,理論建模分析是目前可行的研究手段。因此建立了矩形截面的細胞微流控培養腔理論模型,將外部的物理驅動場(壓力梯度與電場)與培養腔內液體的流速、切應力和流率聯系起來,分別得到了壓力梯度驅動(Pressure gradient driven,PGD)、電場驅動(Electric field driven,EFD)及力-電協同驅動(Pressure-electricity synergic driven,P-ESD)三種驅動方式下的液體流動理論模型。結果表明該理論模型與現有的實驗結果基本一致,具體地:力-電協同作用下的解答為壓力梯度驅動和電場驅動結果的疊加。細胞培養腔內的流體流速、剪應力及流率幅值均正比于外部物理場強幅值,但隨著壓力梯度驅動載荷頻率的增大而減小,隨著電場驅動頻率的變化不明顯。在壓力梯度驅動作用下,細胞貼壁處的切應力隨著腔高的增大而線性增大,流率則隨著腔高的增大而非線性增大,而電場驅動下的結果不受腔高的影響。生理范圍內的溫度場變化對壓力和電場驅動的結果影響不大。另外,在引起細胞響應的流體切應力水平,電場驅動能提供較大的切應力幅值而壓力梯度驅動則能提供較大的流率幅值。該理論模型的建立為細胞微流控生物反應器實驗系統的設計及參數優化提供理論參考,同時也為力-電刺激細胞生長、分化機理的研究的提供基礎。
引言
在臨床治療中,植入自體細胞(考慮到組織的相容性)進行組織修復和重建常被認為是最佳的治療方法。考慮到自身組織移植會造成二次創傷,獲取大量自體細胞最直接的途徑就是進行細胞的體外培養。一些研究發現適宜的物理微環境是細胞生長不可或缺的因素,在體外培養時生物灌流反應器(如圖1)可以方便地模擬體內多種物理微環境。許多實驗室引入了不同的生物反應器進行細胞培養,并證明了液流有利于組織的構建。相比靜態培養,微流控培養腔中的細胞在移植后會對體內的微流動環境具有更強的適應性。人體的一些組織結構(例如骨)在受到外力時會產生變形,進而在組織內微液流環境中形成孔隙壓力和流動電位,這些力、電信號微環境進一步調控當地組織細胞的生長、分化,最終使組織(重/塑建)適應外部載荷環境。在體外細胞培養生物反應器上也可施加壓力和電場進行驅動來模擬體內細胞所處的力-電微環境。很多學者的工作也已經證明壓力和電場的干預可以調控細胞的生長、分化,雖然明確的作用機理(通路)還不是很清楚,但已明確的事實是壓力梯度和電場驅動液體流動產生的流體切應力對細胞生長、分化起到了至關重要的作用。
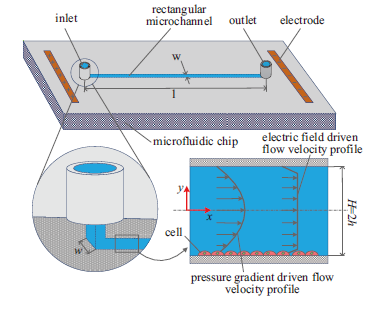
細胞可以感受不同大小的切應力并能做出相應的響應,能較好的將這些細胞能感受的力電信號和宏觀的外載荷聯系起來,微流動場被認為是信號傳導的最佳媒介。Chang等得到了牛頓型液體在電場驅動下的流速分布,Ganguly等考慮了電和磁對壓力驅動流傳熱特性的影響,Movahed等對比了壓力和電場驅動小型設備中液流的優劣。這些研究背景均基于微流控技術,以討論外力和流速的關系為主,微流控技術以其用料少、操作性強和便于觀察分析等優點,近年來受到眾多領域學者的青睞。在生物醫學領域,Pappas在對癌細胞的生長和擴散進行分析時,利用微流控技術建立可控規模的反應區評估癌細胞和器官的相互作用。Uzel等在微流控芯片上設定不同的生化梯度,用于模擬體內細胞所處的化學微環境。Sun則將微流控芯片應用到細胞的篩選工作,并通過電場實現微閥控制。這些研究均以實驗和有限元建模為主要手段,并未建立系統的理論模型進行具體量化分析,并探明如下調控機制:外部物理驅動場→微流體流動行為(流體切應力等)→細胞的生長/分化。
在細胞動態流動培養腔中,細胞多用粘附分子(整合素)將自身吸附在培養腔壁上(避免被液流帶走),這樣使得液流對細胞的力學刺激作用集中在腔壁附近。Becquart等研究發現,處于液體環境中的細胞能感知靜水壓力及流體剪切力的刺激信號,并且發現流體剪切力比靜水壓力對引起相關基因表達的誘導作用更大。Stavenschi等在實驗中利用壓力驅動對比了不同大小和頻率的切應力下細胞的基因表達效果,實驗表明2Pa、2Hz的切應力刺激最有利于成骨基因的表達。Zhang等也通過實驗發現了人類間充質干細胞(MSCs)基因的表達和流體切應力有極大的關系,這個信號傳導過程也受到供體變異性的影響。此外,Zheng等同樣通過實驗探究出壓力驅動作用下的切應力大小影響細胞對刺激的反應時間,并發現切應力較大時有利于縮短該反應時間。液體壓力梯度驅動流對細胞培養的影響的研究大多停留在實驗層面,理論方面鮮有報道。當使用壓力梯度驅動液體在較長的細胞培養腔流動時,力信號的傳遞從施力點(管口)到管段中央具有延遲性。Glawdel將電場驅動引入到細胞的體外培養,因為電場力屬于體力,這樣就可以避免上述壓力梯度驅動力信號沿著腔體長度方向的耗散延遲,從而保證腔內各個位置細胞附近的流體切應力信號均勻。同細胞培養腔中的壓力驅動技術類似,電場驅動或力-電協同驅動研究大都以實驗為主,例如王淞等通過實驗觀察得出電場對表皮干細胞的增殖有影響,內源性生物電場具有引導其向陰極定向遷移的作用,Kumar等在壓力驅動流中添加電場作用后細胞的成骨響應明顯增強,而相關的力-電協同驅動下的細胞培養腔理論研究較少。
考慮到人體內復雜的生理載荷環境,壓力和電場在組織內并存。因此,在體外進行細胞培養時應根據細胞的實際需要組合施加相應的物理場(壓力梯度或電場),使其所處的環境更接近于生理物理環境。以上研究均沒有得到具體的外部物理驅動場與相應培養腔內液體流動行為的量化關系,而這是進一步研究流體刺激特別是力-電協同刺激細胞生長或分化機理的前提。為此,本文將分別建立壓力梯度、電場和力-電協同三種驅動模式下的矩形細胞培養流動腔(平行板培養皿)理論模型,求解得到相應的流速、切應力和流率的解析解,揭示出培養腔中的液體流動規律,并將這些解答和實際的細胞培養等生理意義聯系起來。該模型的建立有助于細胞微流控培養實驗系統及細胞力學參數的優化設計。
免責聲明:文章來源DOI: 10.6052/0459-1879-17-317 以傳播知識、有益學習和研究為宗旨。 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。
標簽: 細胞微流控