微流控粒子分選中圓形微凹槽容納特性研究
摘要:微流控技術(Microfluidics)為粒子和細胞操控提供了新平臺。基于粒子慣性遷移和微凹槽渦胞捕獲的粒子分選方法,成為一種重要的微流控粒子操控技術。目前,微凹槽容納的捕獲粒子數量不高,制約了該方法的效率。為提高微凹槽粒子容量,對圓形微凹槽進行結構設計,并利用高速顯微成像技術和數值模擬,研究了不同圓形微凹槽的粒子容納能力。研究發現,相同入口雷諾數(Re = 37~555)下,帶底腔的圓形微凹槽相較于普通圓形微凹槽容納的粒子數量提升了 45%;當 Re = 444 時,帶底腔的直徑 500 μm 的圓凹槽比直徑 600 μm 的圓凹槽的粒子容量提高了 54.7%,原因是前者凹槽內內粒子運動軌道與流線更加吻合,粒子軌道面積與凹槽面積占比達到了97%;從側通道收集到的 20 μm 粒子的最大富集濃度為初始懸浮液的 126.7 倍。研究結果對微凹槽結構設計、提高粒子分選性能有重要指導意義。
在細胞分析檢測中,從復雜的細胞溶液中對目標細胞進行分選和富集是至關重要的樣本處理步驟。傳統方法,如離心[2]和熒光激活細胞分選,是實驗室和醫院廣泛使用的技術之一,但需要龐大、昂貴的儀器,且存在目標細胞污染和丟失。
微流控技術(Microfluidics)是在微米級通道中操控微小體積流體(10-9~ 10-12L)或樣本的多學科交叉的新興研究領域。由于微通道尺寸與細胞尺寸相當,微流控技術在細胞分選操控方面的能力凸顯出來,具備高效率、高純度和低成本等優勢,成為粒子和細胞分選的新平臺。微流控粒子分選可分為生物方法和物理方法。前者需要對通道壁面進行生物化學修飾,后者基于細胞物理性質差異(尺寸、密度、表面電荷量和變形性等),可再分為主動式和被動式兩種。主動式需要外加力場(磁、電、光、聲等),被動式僅通過設計巧妙的通道結構,利用微通道中流體流動來操控粒子運動。其中,慣性微流控技術(Inertial Microfluidics)僅利用微通道中粒子和流體的慣性效應實現分選,成為了被動式物理方法的代表。慣性升力驅動顆粒發生側向遷移,通過改變通道形狀和入口流速等調控顆粒的運動,實現顆粒的遷移聚焦,微通道幾何形狀包括:彎曲通道、螺旋通道和蛇形通道等。
基于微凹槽渦的粒子分選方法充分利用直通道中粒子慣性遷移和微凹槽內的渦胞流動,可以將含量極低的(10-9)循環腫瘤細胞(Circulating Tumor Cells, CTCs,12~30 μm)從全血細胞中分選出來,且可實現目標粒子的富集,具有結構簡單、并行化、效率高、細胞損傷小等優點,成為了一種重要的慣性微流控方法,有望成為實現癌癥“液體活檢(Liquid Biopsy)”的關鍵技術。
自 Di Carlo 團隊首次報道了基于微凹槽渦的粒子分選方法以來,為了提高粒子分選效率,許多研究者對矩形凹槽尺寸、長寬比和入口流速等因素進行了優化研究。Zhou 等對矩形凹槽尺寸、粒子直徑及濃度等因素進行了實驗和流場仿真,發現隨入口雷諾數(Reynolds number,Re)增大(130-330),單個 400×400 μm2 凹槽內粒子數量先增多后減少的現象(最大值<40 個)。Haddadi 等對凹槽尺寸和工況進行了優化,也發現凹槽會達到飽和狀態,制約了該方法的分選效率,并改進了凹槽排布方式。此外,Wang 等在矩形凹槽側面增加了排液通道,實現了目標粒子的連續排出與收集。Volpe 等設計了一種立體式芯片結構,側通道排出的粒子直接流入下面的收集池。然而,多個凹槽并行時,需要設計更多的出口通道。
目前研究,多關注該方法的技術應用,對微凹槽渦內的粒子軌道運動行為認識尚不深入,需要將其中的微凹槽容納機理獨立出來研究。當凹槽容量飽和時,捕獲的目標粒子發生逸出,從而限制了分選性能,阻礙了其臨床應用。提高凹槽粒子容量,既可以提高分選效率,又提高了目標粒子富集濃度,有利于進一步的細胞檢測。
作者前期研究發現矩形凹槽結構與粒子運動軌道并不吻合,并首次采用圓形微凹槽進行粒子分選實驗,發現圓形凹槽結構與粒子軌道更加吻合,粒子數量和濃度分別提高了 3~5 倍和 2~4 倍。本文進一步對圓形凹槽進行結構優化探索,設計了8 種圓形凹槽結構,并開展了顯微高速攝影實驗和數值仿真,對比研究了不同凹槽幾何因素和 Re 對粒子容量影響,并結合粒子運動軌道和流場仿真初步探討了圓凹槽粒子容納機理。
1 實驗材料和方法
1.1 微流控芯片
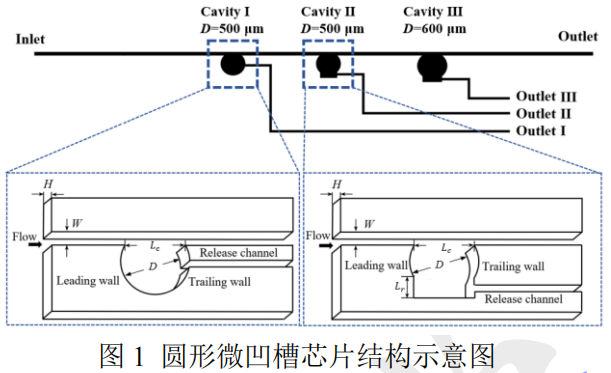
微流控芯片由主通道和三個不同形狀的圓凹槽(Cavity I、II、III)組成,如圖 1 所示。主通道寬度為 W=80 μm,深度為 H=100 μm。凹槽入口寬度均為 Lc=400 μm,凹槽 I、II 的圓形區域直徑為 D=500μm,而凹槽 III 為 D=600 μm,以研究圓凹槽尺寸對粒子容量的影響。凹槽 II、III 的下方設計了 400′200μm2 底腔,以研究底腔對容量的影響。凹槽間距為2000 μm,側方連接出口通道,用于釋放捕獲的目標粒子。制作微流控芯片的材料為聚二甲基硅氧烷(Polydimethylsiloxanes,PDMS),模具由標準光刻蝕技術制作。前人研究中為了使粒子慣性聚焦到直通道兩側平衡位置,寬度一般設置為 60-80μm。由于尺寸較小的微凹槽的空間有限,容納的目標粒子少,而較大的凹槽形成渦流的臨界 Re較高,導致切應力升高,對細胞產生損傷,故實驗中的凹槽直徑為 500 μm 和 600 μm 兩種。
1.2 實驗系統
實驗中,在去離子水中加入聚苯乙烯小球模擬真實稀釋的血液,同時加入表面活性劑 Tween20以防止粒子發生團聚或粘附于通道壁面。目前研究中常采用粒子代替真實 CTCs 細胞,開展機理研究,為細胞分選應用提供理論指導。實驗過程中,首先關閉粒子釋放出口,然后用注射泵將注射器中的混合液從主通道入口 Inlet注入,流量 Q 為 0.8~2.2 mL/min。粒子經過凹槽捕獲后,剩余混合液從主通道出口 Outlet 流出。當凹槽容納的目標粒子數量飽和后,并打開出口通道,收集得到高濃度的目標粒子溶液。

高速顯微成像系統由倒置顯微鏡、高速攝像機和數據采集系統組成,如圖 2 所示。對凹槽內捕獲的目標粒子運動進行觀測和記錄,視頻分辨率為832×600 像素,幀率為 10KHz。采用 Matlab和 ImageJ軟件對粒子圖像進行處理,得到粒子運動軌跡和疊加圖像等。實驗在 25 ℃的室溫下進行。
1.3 數值仿真
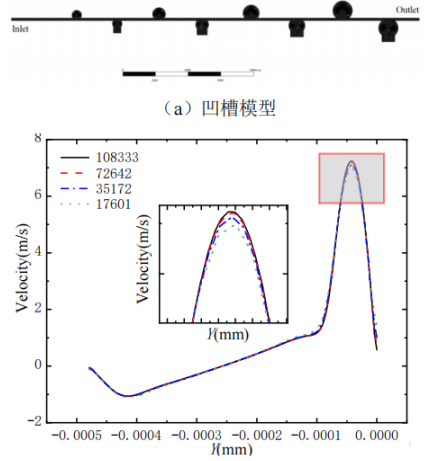
利用 ANSYS-Fluent(V19.0)進行微凹槽流場特性數值模擬,主要過程包括:模型建立、網格劃分、網格優化及獨立性驗證、邊界及條件設置、運算求解和結果后處理分析等。首先,通過建模軟件SolidWorks 建立微通道流域三維模型,如圖 3(a)所示,包括 4 組凹槽結構。由于粒子分選捕獲過程中側通道出口是關閉的,故建模時簡化掉了側通道。然后,通過 Hypermesh 軟件進行模型的網格劃分,采用非結構化四面體網格。最后,采用去離子水作為工作流體,設置流量入口(Q)和壓力出口大氣壓(Patm)條件,壁面均采用無滑移邊界條件,選擇層流模型,采用SIMPLE 算法來求解速度場和壓力場耦合的問題,求解控制方程,收斂精度為 10-5。為提高計算準確性,進行了網格優化和獨立性驗證。提取了不同網格數量模型直徑 500 μm 圓形凹槽中心處 y 方向的速度分布,如圖 3(b)所示。由圖可知,當網格量大于 72642 時,速度基本不再變化,計算結果與網格數量無關。
1.4 微凹槽粒子容納機理
微流控系統中流體一般處于層流或斯托克斯流(Stokes flow)狀態(Re→0),但高通量時,中部范圍流動(Intermediate flow)狀態(~1<Re <100)甚至 re="">100 的流動均出現在微通道內,此時流體慣性作用不可忽略,Re、界面張力和粘度等參數對流場和粒子運動產生重要影響。粒子流動可通過微通道雷諾數 Re 和粒子雷諾數 Rep 表征:
剛性顆粒在受限直通道泊肅葉流中運動受到四個橫向升力作用:由于滑移-自旋效應的馬格努斯升力、由于滑移-剪切效應的薩夫曼升力、壁面誘導升力和剪切梯度升力。其中,馬格努斯升力和薩夫曼升力通常非常小,可以忽略不計。剪切梯度升力(FLS)和壁面誘導升力(FLW)是顆粒橫向遷移的主要影響因素,前者引導粒子向通道壁面移動,后者排斥粒子向通道中心線移動。
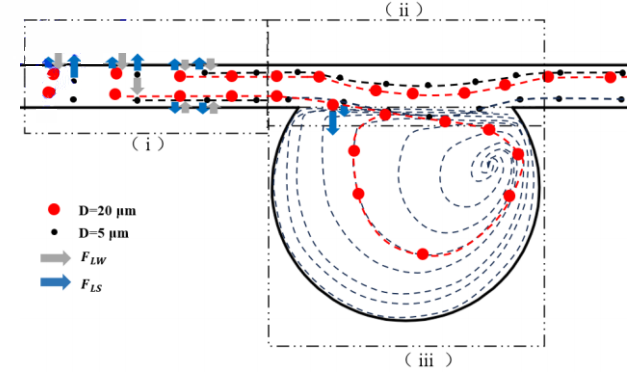
凹槽粒子分選過程分三個步驟,如圖 4 所示:(i)直通道粒子慣性聚焦:在 FLS 和 FLW 的作用下,大小粒子發生慣性遷移,聚焦到通道側壁面附近的平衡位置;(ii)凹槽入口區域粒子橫向遷移:FLW降低,FLS 主導粒子向凹槽底部遷移,遷移速度與粒徑成正比;(iii)微凹槽渦內粒子軌道循環運動:被捕獲的目標粒子在凹槽內隨渦胞做周期性軌道循環運動,對凹槽粒子容量有重要影響。
免責聲明:文章來源力學學報 以傳播知識、有益學習和研究為宗旨。 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。
標簽: 微流控芯片