用于輻射計量即時檢測的高通量液滴微流控芯片
隨著核醫學、核電等核技術的廣泛應用,意外核事故等突發公共事件發生的可能性顯著增加。機體受到高劑量電離輻射(> 1 Gy)后可導致急性放射綜合征(ARS)。ARS常涉及多種組織器官系統的損傷,輕則出現惡心、嘔吐等癥狀,重則導致死亡。根據不同的臨床表現和結局,ARS一般分為造血系統型(2 Gy ~ 6 Gy)、胃腸型(6 Gy ~ 10 Gy)和腦型(> 10 Gy)等亞綜合征,與人體吸收的輻射劑量緊密相關。因此,輻射暴露人員受照劑量的準確測定對于放射事故后潛在暴露個體的醫學處置至關重要。在過去幾十年里,細胞微核和雙著絲粒測定等生物劑量測定方法已被用于輻射暴露的真實案例中。然而,這些檢測方法仍然存在一定的局限性,特別是檢測前需要最短48小時的細胞培養時間,因而難以實現簡便、快速和高通量等要求。因此,亟需發現新的更為高效的輻射劑量生物標志物并開發高通量檢測方法,以應對突發放射性事件中潛在受照個體的大規模篩查、診斷和醫學分類。
近日,軍事科學院軍事醫學研究院研究員周鋼橋/盧一鳴團隊與 北京航空航天大學生物與醫學工程學院常凌乾課題組在 Nature Communications和 Biosensors & Bioelectronics期刊上發表系列研究工作,發現了基于RNA的N6-甲基腺苷(m6A)修飾的新型輻射劑量生物標志物,并開發了相應的高通量微流控芯片檢測方法。首先,周鋼橋/盧一鳴團隊在 Nature Communications期刊上發表了題為“RNA N6-methyladenosine modification-based biomarkers for absorbed ionizing radiation dose estimation ”的研究論文。該研究首次發現了基于RNA m6A修飾的新型輻射暴露劑量生物標志物,并建立了基于該修飾的人體輻射暴露劑量預測模型,為意外核事故后輻射暴露人員受照劑量的高通量測定和醫學分類提供了全新方案。
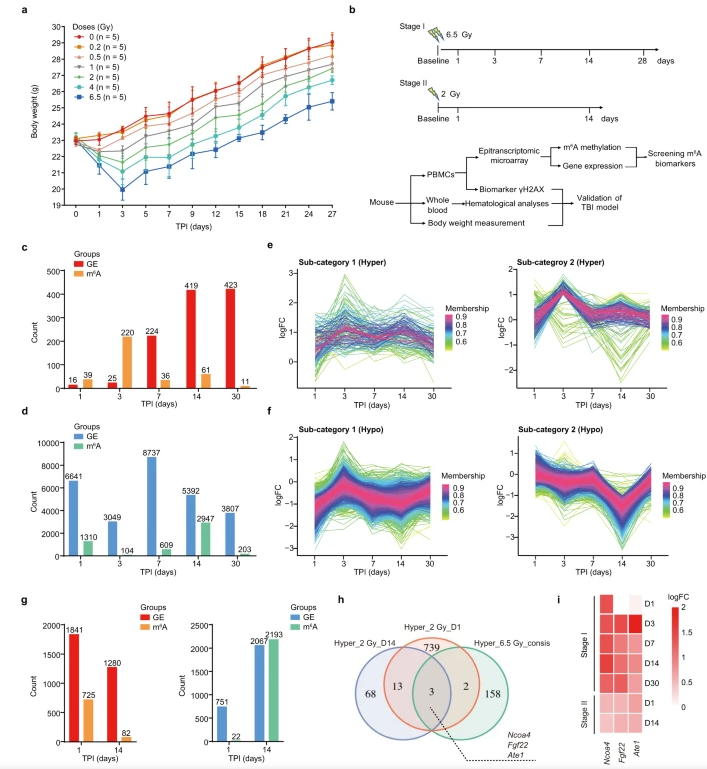
輻照小鼠PBMCs轉錄組和表觀轉錄組的動態變化。
研究者首先對小鼠外周血單個核細胞(PBMC)中響應電離輻射的mRNA分子進行了全轉錄組篩選,發現急性電離輻射暴露后RNA m6A水平發生顯著的變化。而且,與RNA轉錄水平相比,RNA m6A修飾水平的改變更加穩定和持久,提示其更適合作為暴露后中長期有效的輻射標志物。其中,Ncoa4、Ate1和Fgf22三個基因的RNA m6A修飾水平在輻射暴露小鼠PBMC中表現出良好的量效關系,提示它們可以作為輻射暴露的生物標志物。特別是,Ncoa4基因的RNA m6A在輻射暴露后長達28天仍處于顯著升高狀態,提示其作為理想輻射標志物的優良表現。研究者進一步排除了其他混雜因素,如炎癥、性別和年齡等對量效關系的影響,證明了其對電離輻射的反應特異性。
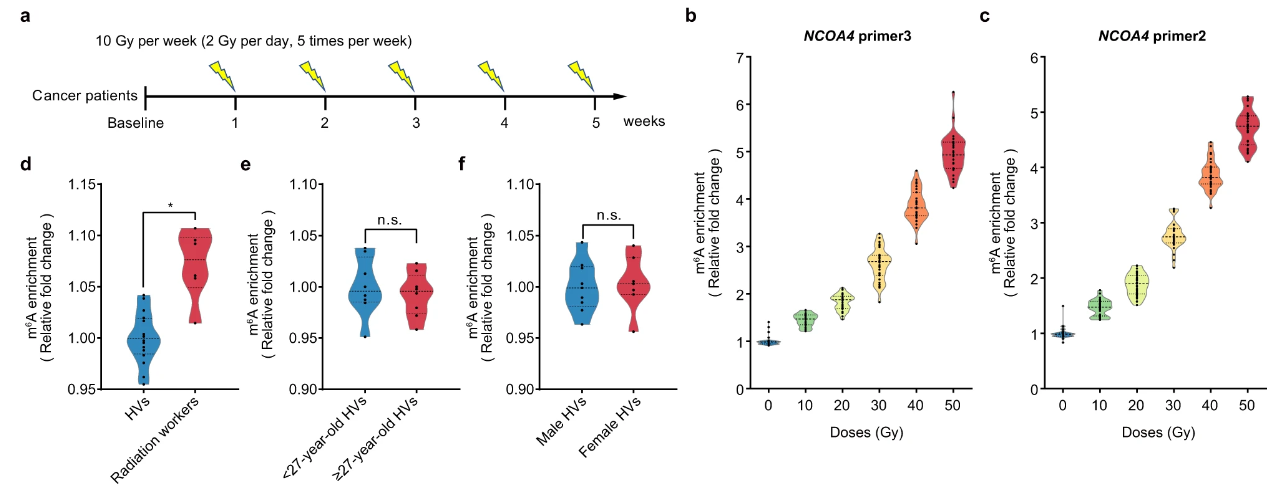
m6A 修飾的 NCOA4 mRNA 在輻射暴露人類的 PBMC 中的反應
快速和高通量生物劑量計對于放射事故后的有效醫療管理至關重要,在放射事故中,大量個體可能會暴露在未知劑量的輻射下。在這里,我們對輻射響應的 mRNA 轉錄本進行了全轉錄組篩選,其 m6A 修飾水平揭示了急性輻射暴露后的顯著變化。我們發現 Ncoa4、Ate1 和 Fgf22 三個基因的 RNA m6A 水平顯示出良好的劑量反應性,因此可能作為輻射暴露的候選生物標志物。特別是NCOR4 mRNA的m6A修飾在跨物種保守性、劑量反應性、響應特異性和較長的輻射檢測持續時間方面表現出優異的性能。據我們所知,這是第一項評估RNA m6A修飾作為候選生物標志物在檢測輻射暴露中的應用的研究。
最近,幾項研究揭示了m6A RNA甲基化與多種遺傳毒性和非遺傳毒性應激之間的密切關系。例如,在紫外線的應激下,m6A RNA 和 METTL16(一種 m6A 甲基轉移酶)被募集到 DNA 損傷位點,并通過促進核苷酸切除修復 (NER) 途徑促進 DNA 修復。亞砷酸鹽誘導的氧化應激可以增加編碼RNA m6A“寫入者”的兩個基因WTAP和METTL的表達,以及整體m6A水平,進而調節靶RNA響應氧化應激。作為對電離輻射的響應,METTL3(另一種 m6A 甲基轉移酶)和 FTO(一種 m6A 去甲基化酶)已被證明以 RNA m6A 介導的方式有助于抗輻射。此外,新出現的證據表明 RNA m6A 對其他類型的應激起著關鍵作用,包括缺氧、治療應激、代謝應激和內質網 (ER) 應激。因此,這些發現表明了關注RNA m6A修飾以篩選響應輻照的候選生物標志物的機會。
事實上,一些開創性的研究已經暗示了RNA m6A修飾作為多種疾病生物標志物的潛力。在癌癥方面,基于IGF2BP2、IGF2BP3、KIAA1429、METTL3、EIF3H和LRPPRC表達的m6A評分被報道為胰腺腫瘤微環境狀態的指標,是患者預后的潛在生物標志物。METTL3在多種癌癥組織中的表達水平顯著升高,與患者的不良預后有關。此外,證據還表明m6A甲基化相關基因的表達譜是代謝異常和心血管疾病的候選生物標志物。然而,到目前為止,還沒有研究直接評估RNA m6A修飾本身作為生物標志物的能力。據我們所知,這是第一項評估特定基因的RNA m6A甲基化水平作為生物標志物的應用的研究,不僅限于輻射相關的生物標志物。綜上所述,我們系統地篩選和評估了RNA m6A修飾在輻射劑量評估中的可行性。特別是m6A修飾NCOA4在劑量反應性、時間動力學、反應特異性和跨物種保守性方面的突出表現,表明其在輻射事故管理和臨床應用中具有潛在的應用價值。
研究者進一步通過在小鼠、猴子和人類中的保守性分析發現,上述三個基因均具有跨物種高度保守的m6A修飾位點。尤其是,基于NCOA4基因中的保守m6A修飾位點,研究者分別建立了恒河猴、人類細胞系及人類PBMC的輻射暴露模型,發現在非人靈長類和人類中NCOA4 m6A修飾水平仍然具有良好的量效關系。此外,研究者招募了33例接受局部放射治療的腫瘤患者,發現這些患者接受不同劑量放射治療后其PBMC中NCOA4 m6A修飾水平與受照劑量也具有良好的量效關系。
最后,研究者利用多因素非線性回歸模型構建了基于NCOA4/Ncoa4 m6A修飾水平的輻射暴露劑量預測模型,可前瞻性準確預測小鼠或人體吸收的輻射劑量。例如,該模型對于小鼠受照劑量的預測準確度高達96.6%,對于臨床放療患者的受照劑量預測準確度達到90.1%。總之,這項研究發現了多個基于RNA m6A修飾的候選輻射暴露標志物,并建立了基于這些修飾的人體輻射暴露劑量預測模型,證明了RNA m6A修飾在輻射受照人員醫學分類和臨床應用中的潛在可行性。
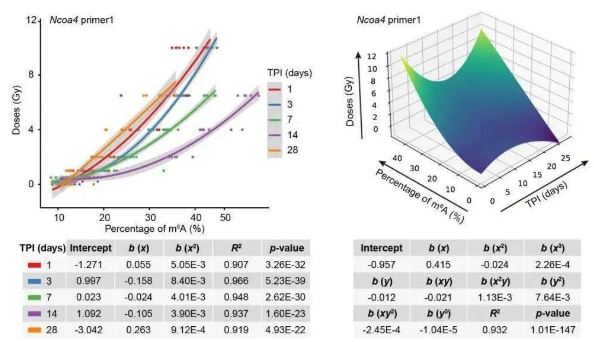
基于Ncoa4 m6A修飾水平的輻射暴露劑量預測模型
軍事科學院軍事醫學研究院周鋼橋研究員和盧一鳴副研究員為論文的共同通訊作者;軍事科學院軍事醫學研究院陳紅霞副研究員、趙曦博士和解放軍總醫院第一醫學中心放射治療科楊微主治醫師為本文的共同第一作者。
為了進一步高效檢測上述新發現的NCOA4 m6A修飾標志物,軍事醫學研究院周鋼橋/盧一鳴團隊與北京航空航天大學生物與醫學工程學院常凌乾課題組合作,近日又在 Biosensors & Bioelectronics期刊上發表了題為“Sensitive, rapid detection of NCOA4-m6A towards precisely quantifying radiation dosage on a Cas13a-Microdroplet platform ”的研究論文。
該研究針對NCOA4 m6A修飾位點進行靶向設計,并基于CRISPR/Cas基因編輯技術設計了一種新型液滴微流控芯片系統(Cas13a-液滴微流控芯片平臺)。在原理上,該 Cas13a-液滴微流控芯片平臺可產生均勻的微液滴,每個液滴中包裹了NCOA4 m6A和CRISPR/Cas13a檢測系統。其中,Cas13a可識別NCOA4 m6A修飾位點并進一步切割熒光報告分子,在20分鐘內即可產生放大的熒光信號,通過計量陽性液滴數的比例即可實現直觀的定量。此外,該平臺可使反應體積從微升(μL)級減少到皮升(pL)級,從而能在比傳統方法更低的靶標濃度下實現高度靈敏的定量檢測。該平臺的靈敏度和快速反應性在受照小鼠模型和臨床放療患者樣本中都得到了驗證。此外,與經典的實驗室級別的m6A檢測方法MeRIP-qPCR相比,該微流控芯片平臺檢測NCOA4 m6A的靈敏度增加了兩倍。總之,軍事醫學研究院和北航兩個團隊跨學科合作開發的 Cas13a-液滴微流控芯片平臺能夠實現人體受照電離輻射劑量的快速、高靈敏度和高通量檢測,為輻射暴露人員受照劑量的高通量測定和醫學分類提供了全新的技術手段。
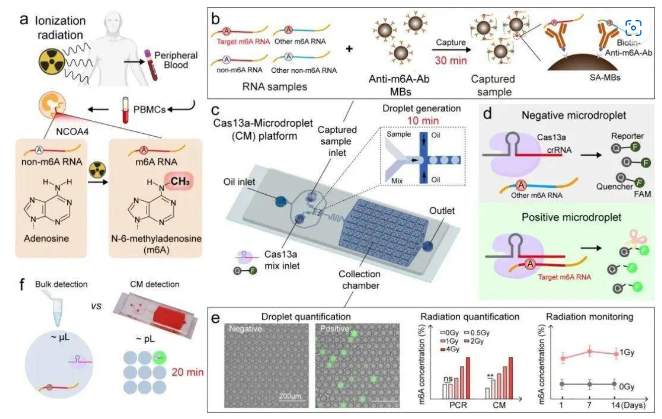
Cas13a-液滴微流控芯片平臺通過檢測NCOA4 m6A水平來確定輻射劑量的原理示意圖
免責聲明:文章來源網絡 以傳播知識、有益學習和研究為宗旨。 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。
標簽: 液滴微流控芯片