用于微流控肺芯片應用的氣液界面和優化的細胞培養基質
肺氣液界面氣體交換導論
肺是呼吸的主要器官,其功能是促進血液中的氣體交換。空氣沿著支氣管樹向下輸送到肺泡囊,在那里氣體與毛細血管腔通過空氣-血液屏障進行交換(圖1)。
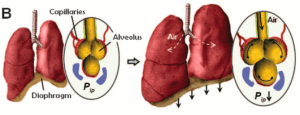
支氣管纖毛排列在呼吸道內,它們的跳動推動粘液和塵埃進入呼吸道。肺泡囊內襯有肺泡上皮細胞,這些細胞與下面的血管內皮細胞共用一層基底膜,形成一層薄薄的氣液界面。對肺泡上皮細胞的壓力增加了磷脂(肺表面活性物質)的產生,從而降低了肺泡壁的表面張力,從而改善了屏障功能。
肺器官芯片微流體:氣液界面的模擬
下一代肺模型將半透膜結合到微流控三維芯片上器官技術中,目的是比傳統的二維細胞培養更接近地模擬復雜的生理性肺微環境。由Huh等人設計的最先進的單芯片肺系統。在Wyss研究所,[1]包含兩個腔室,模擬充滿空氣的肺泡囊和充滿血液的毛細管腔,由代表空氣-血液屏障的薄膜隔開(圖2)。用柔性硅基有機聚合物聚二甲基硅氧烷(PDMS)模擬半透膜,在空氣界面種植肺泡上皮細胞,在血漿界面種植血管內皮細胞。通過膜兩側的專用微流控通道通過真空引入循環應變,以模擬呼吸所面臨的肺泡組織的生理壓力,促進生理相互作用和功能的復制。具體地說,相鄰細胞類型之間形成了連接,產生了肺表面活性物質,屏障孔隙度接近生理性。
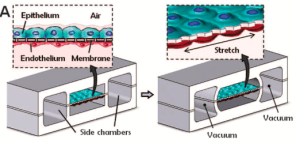
圖2:肺器官芯片微流控裝置
模型氣液界面的一個基本特征是它能夠作為細胞培養的底物。這樣的底物應該促進細胞附著、增殖、分化和相互作用,理想情況下,能夠復制組織的關鍵功能特征,如氣體滲透性、表面活性物質生產和纖毛跳動。在這篇綜述中,我們簡要概述了氣液界面的重要特征,以及目前一些設計和修改它們的方法,以優化芯片上的肺模型。具體地說,我們著重于氣液界面的物理、生化和機械性質的可調性。
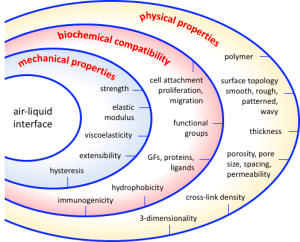
圖3:氣-液界面設計和修改的物理、生化和機械考慮因素綜述
方框1:PDMS。氣-液界面通常用聚二甲基硅氧烷(PDMS)模擬。PDMS的優點是成本低、易于快速澆注、透氣性好、光學透明度高、自發熒光低。它是柔韌的,相對柔軟(彈性模數~1-3兆帕)。經等離子體氧化處理后,聚二甲基硅氧烷可與其他材料或自身結合。缺點包括缺乏細胞的生物和化學線索,以及高度疏水性。根據不同的應用,PDMS膜的滲透性、表面特性和柔軟性可能會因調整而受益。
微流控裝置中氣液界面的物理設計考慮
膜的尺寸、形貌、孔隙率和溶脹等物理性質會影響細胞的行為(如黏附和遷移),并影響屏障功能(如滲透性或滲漏)。集成對各種物理特性的更高控制將促進氣液界面的微調和特定功能的優化。
孔隙結構
孔隙率決定了對氣體和營養物質的滲透性,也調節了種植在膜兩側的細胞類型的遷移能力和相互作用。聚碳酸酯或聚對苯二甲酸乙二醇酯(PET)膜是兩種現成的選擇,通常用于模擬氣-液界面,并有多種孔徑可供選擇。多孔網絡可通過顆粒浸出、氣體發泡或冷凍干燥技術引入PDMS材料。或者,可以使用制造的模具和掩模(圖4)以及使用各種光刻或蝕刻技術應用的圖案來精確定制孔直徑、厚度和孔與孔之間的距離。

圖4.控制襯底孔隙率
拓撲
表面拓撲提供的物理(空間)線索調節細胞的附著、鋪展和排列。值得注意的是,細胞的生理微環境很少是平坦光滑的表面。調節氣液界面的拓撲結構可以更好地模擬組織的復雜紋理,如呼吸膜的大表面積和高曲率。材料表面可以是光滑的、納米粗糙的,或者用一系列凹槽或定制設計圖案化,通過光刻或蝕刻轉移(圖5)[4]。可調參數包括微槽的間距和高度、它們的相對方向(平行、半對齊或隨機)以及邊緣的角度(即矩形或圓形)。
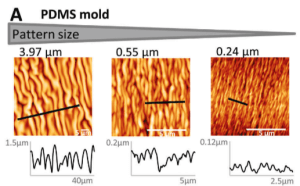
圖5.控制表面粗糙度和圖案化
維度
天然細胞微環境的多層幾何結構可以通過增加支架的維度來建模。具體地說,三維支架增強了細胞-細胞界面的形成和組織結構。模仿天然ECM支架的多孔纖維網絡可以使用靜電紡絲技術進行編織(圖6)。纖維厚度、材料孔隙率和膨脹率可以通過調節流量來控制。另外,天然紋理的犧牲性鑄造基板(例如,方糖)已被用于將復雜的三維建筑轉移到PDMS。材料的膨脹或收縮程度可以通過選擇所使用的聚合物和交聯劑以及交聯劑的密度來改變。

圖6.不同流速下PDMS和彈性蛋白的電紡纖維基材
微流控裝置氣液界面的生化設計考慮
生物和化學刺激,如生長因子、藥物、其他細胞和細胞黏附分子,長期以來一直被認為是細胞行為的重要調節因素(圖7)。對氣液界面進行修飾以加入蛋白質和其他生物活性化合物、調節底物的潤濕性(疏水性)或加入官能團是改善在氣液界面培養的細胞生長和功能的最常用方法之一。此外,基質的選擇應確保降解不會導致細胞毒性副產物,也不會對基質孔隙率、拓撲結構或機械性能產生不利影響。
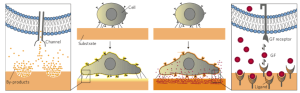
圖7.細胞行為可能受到細胞或底物釋放的生物分子或底物副產物的影響
表面疏水性
PDMS是一種疏水聚合物。疏水表面的一個缺點是許多小分子和熒光藥物或染料非特異性地吸附。等離子體氧化處理使表面親水,但效果只是暫時的(幾個小時)。更持久地改善表面潤濕性的方法包括涂覆多聚賴氨酸、非離子表面活性劑或吸附或固定配體、蛋白質或官能團。
基質蛋白
PDMS和其他合成聚合物基質的細胞生物相容性通常通過細胞外基質(ECM)蛋白的處理而增強,尤其是膠原和纖維連接蛋白[1],它們促進和增強細胞的附著和增殖。溶液中的蛋白質可以通過涂層或微接觸打印被吸附到PDMS的表面,或者使用一系列策略固定,例如用(3-氨丙基)三乙氧基硅烷(APTES)處理、交聯劑(例如,戊二醛、基于聚乙二醇基的連接物)或等離子體活化。
官能團
可以引入廣泛的官能團(例如甲基丙烯酸酯、磷酸鹽、羧基、氨基、硫醇、丁基),以幫助吸附和/或隔離生物分子,如糖蛋白和生長因子,以促進細胞生長[7]。官能團可以通過接枝或聚合的方法添加,包括表面等離子體活化和化學修飾。
微流控裝置中氣液界面的機械設計考慮
除了生化和物理信號外,越來越清楚的是,機械應力對細胞生長和組織功能同樣重要(圖8)。例如,基質硬度可以指導干細胞分化的譜系,基質應力松弛(一種粘彈性特性)調節細胞的擴散、增殖[10]和支架重構,呼吸過程中施加的機械應力影響納米顆粒通過肺泡空氣-血液屏障的攝取。與健康組織相比,肺氣腫、纖維組織和癌癥等疾病狀態會改變基質硬度,影響疾病進展、重塑和修復過程中的細胞命運。微流控芯片肺培養提供了模擬生理流體切應力和呼吸動力的方法。因此,機械可調襯底有望增強這些模型的功能。
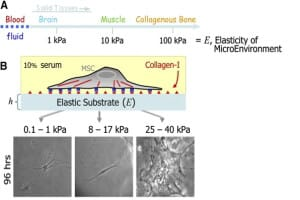
圖8.基質硬度和粘彈性影響干細胞的命運
聚合物共混物
PDMS是由長的柔性單體鏈組成的,這些單體鏈以一定的間隔進行交聯。一旦固化,這種柔性材料相對較軟(彈性模數~1-3兆帕),并表現出較低的粘彈性滯后(能量耗散)。改變基料與固化劑的比例(例如,5:1、10:1、20:1)會改變拉伸硬度,從而調節細胞生長。然而,使用非化學計量的堿基與連接物的比例可能會導致非交聯型單體的緩慢釋放,從而產生不良的效果。另一種方法是將不同的PDMS類型(例如,Sylgard 184和Sylgard 527)以最佳的堿基與連接物比例混合,從而產生超過三個數量級的剛性調制(彈性模數范圍從5 kpa到1.7兆帕)。幾種通常用作滲透膜的聚合物(如PC、PET和聚乳酸)由于其較高的(GPA)硬度而不太適合于包括機械刺激的應用。
ECM蛋白
纖維性細胞外基質蛋白主要對組織中的機械力做出反應,包括抗拉強度(膠原蛋白)和彈性拉伸和回彈(彈性蛋白)。不同的組織具有不同的結構蛋白組成,因此具有不同的機械性能,反映了它們的生理需求。將PDMS或其他合成聚合物與ECM蛋白質混合,為調節用作氣-液界面的材料的機械性能提供了另一種策略。可以通過改變蛋白質組成、交聯劑和交聯劑密度來調整機械性能。
標簽: 微流控芯片