器官芯片實例介紹:(一)肺芯片 lung on a chip
肺芯片被設計用于改善現有體外肺泡 - 毛細血管界面模型的生理相關性,這種多功能微實驗平臺可以再現人肺泡毛細血管界面(即活肺的基本功能單元)的關鍵結構、功能和機械性質。Wyss Institute的Dongeun Huh受哈佛大學的生物啟發工程部的委托,設計了一個由PDMS制成的薄(10μm)多孔柔性膜分開的兩個緊密貼合的微通道結構。該裝置主要包括三個微流體通道,只有中間有多孔膜,如圖所示。將不同的細胞培養在膜兩側生長:一側為人肺泡上皮細胞,另一側為人肺微血管內皮細胞。通道的分隔不僅有助于將空氣流作為流體將細胞和營養物遞送到上皮的頂端表面,而且還允許中間和側面通道之間存在壓力差。在人類呼吸循環的正常啟動過程中,胸膜內壓降低,引起肺泡擴張。當空氣被吸入肺部時,毛細血管中的肺泡上皮和耦合的內皮被拉伸。由于側通道連接到真空,引起壓力降低導致了中間通道擴張,從而拉伸多孔膜,隨后拉伸整個肺泡-毛細管界面。
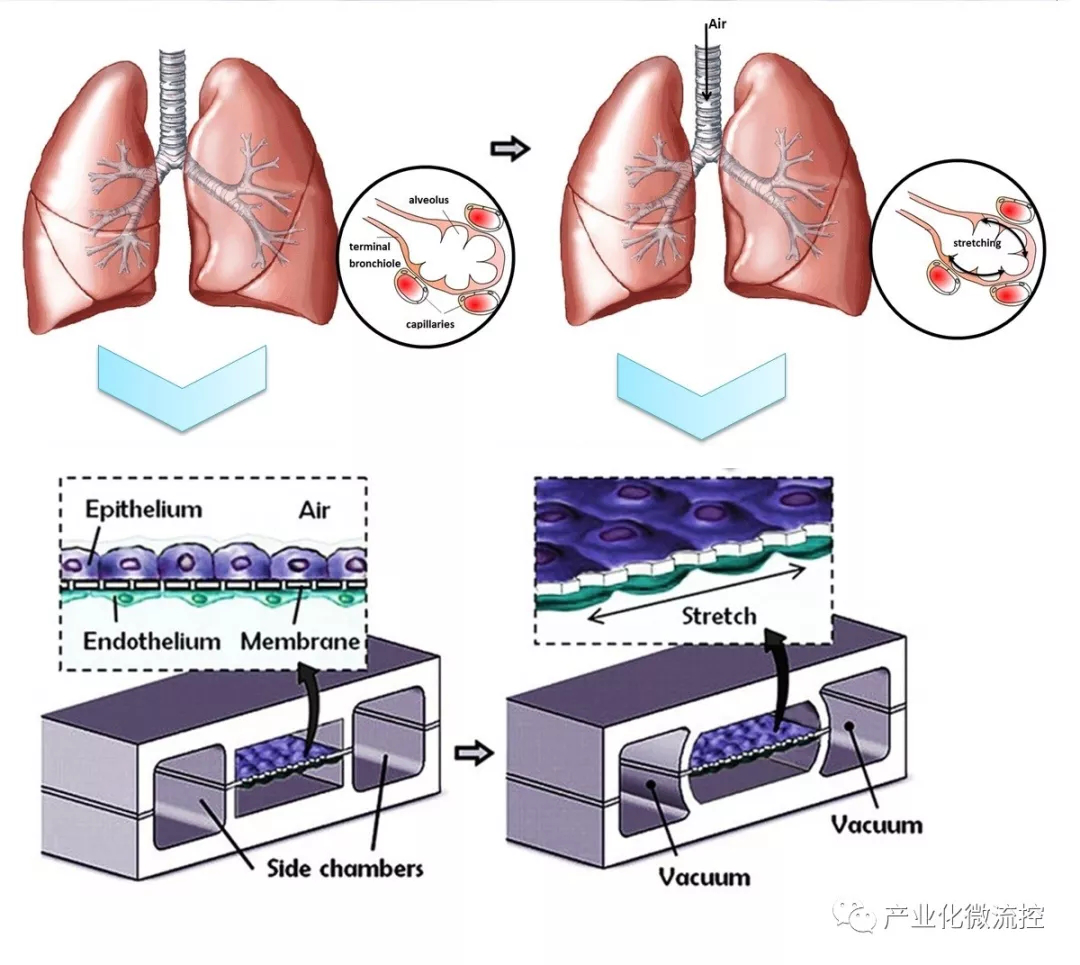
圖1 肺芯片裝置及功能示意圖:該裝置由三個中空微通道組成,只有中間通道在水平方向被多孔膜隔成兩個部分,在多孔膜的兩側分別接種內皮細胞或上皮組織細胞。側通道連接真空泵,可通過氣泵對膜進行拉伸以模擬由于隔膜的收縮引起胸膜內壓降低,所導致的肺泡擴張。
壓力驅動膜拉伸的動態運動也被描述為周期性機械應變(值約為10%),與該裝置的靜態培養以及Transwell細胞培養系統相比,顯著增加了穿過多孔膜的納米顆粒易位速率。為了充分驗證器件的生物學效用性,必須對整個肺器官的反應進行評估。在這種情況下,研究人員一共做了兩個實驗:
?肺部炎癥
肺部炎癥反應一個多步驟的反應過程,但是隨著上皮細胞產生的增加和細胞因子的早期應答釋放,界面的細胞粘附分子數量[5]應該會增加。在Huh的實驗中,通過加入含有強力促炎介質的培養基來模擬肺部炎癥。在造成損傷后幾小時,微流控裝置中的細胞根據前述生物反應受到環狀應變的而發生響應。
?肺部感染
使用大腸桿菌系統來證明甚至可以模擬細菌肺部感染的自然細胞反應。將細菌引入肺泡上皮的頂端表面之后的幾小時內,在肺泡腔中能檢測到嗜中性粒細胞,這意味著它們已經從血管微通道轉移,多孔膜已經開始吞噬細菌。
此外,研究人員認為,這種肺片上系統的潛在價值將有助于毒理學應用。 通過調查對納米顆粒的肺部反應,研究人員希望在某些環境中更多地了解健康風險,并糾正以前過于簡單的體外模型。 因為微流體肺上芯片可以更精確地再現活人肺的機械性質,因此其生理反應將比Transwell培養系統更快更準確。 然而,已發表的研究承認,肺片上的反應尚未完全復制天然肺泡上皮細胞的反應。
(作者:陳有靈犀 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除)