從“抓得著”到“不用抓”:直接檢測血液樣本中循環腫瘤細胞
CTC
循環腫瘤細胞,是存在于外周血中各類腫瘤細胞的總稱,來源于實體腫瘤病灶的細胞脫落。檢測血液中的CTC可以實時監測腫瘤動態、評估療效,實現實時個體治療。
由于CTC在血液中的含量極微:大約為每109 (10億)個血細胞或每106-7個白細胞中存在1個CTC。所以對CTC的檢測首先要求富集到高純度的CTC,然后再做檢測(免疫熒光、FISH等)。
隨著單細胞測序、納米管芯片、納米探針技術的加入,CTC檢測規則已重置:1)捕獲:從“抓得著”變為“不用抓”;2)分析:從計數/分型到單細胞分析。
抓得著:碳納米管芯片
《Lab on a Chip》上月底報道了一項新技術:碳納米管芯片(nanotube-CTC-chip),可捕獲所有大小和類型的CTC。
研究人員利用熒光染料標記已知數量的腫瘤細胞對這種新型芯片進行驗證,其靈敏性極高:受試樣本中89%至100%的腫瘤細胞都能被成功捕獲。
另外,科研人員還在乳腺癌患者(Ⅰ-Ⅳ期)中對此項技術進行了驗證:CTC在乳腺癌患者(7例)中被成功識別,而在健康對照組(2例)中未發現CTC。
抓得著+單細胞分析:Hydro-Seq
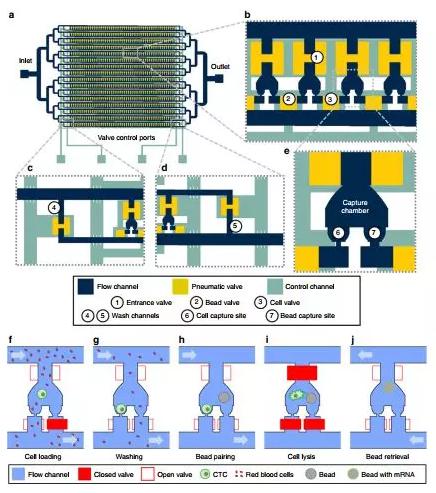
今年5月來自美國密歇根大學的科學家在《Nature Communications》上發表了其研發的新型CTC檢測方法:Hydro-Seq。
Hydro-Seq技術采用的微流控芯片可捕獲純CTC,完全不會受紅細胞和白細胞的污染,同時與傳統的免疫熒光染色技術相比,Hydro-Seq技術為CTC的全轉錄組測序提供了更加全面的分析。
研究人員將約100個腫瘤細胞混入10mL健康受試者的樣本中,經過驗證,Hydro-Seq的捕獲率為90.43±6.08% 。
另外,研究人員采用Hydro-Seq技術對21例乳腺癌患者血液中收集的666個CTC進行了全面分析,證實了即使是同一患者,其癌細胞的表型也存在較大差異,即證實了癌癥轉移是具有癌癥干細胞特征的癌細胞介導的,這些細胞處于上皮-間質不斷相互轉換的狀態中。
不用抓:鑭系發光納米探針
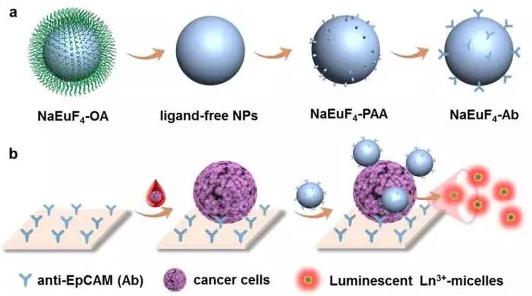
本月來自中國的科學家在《Angewandte Chemie International Edition》上發表了其最新研究成果:一種基于時間分辨的鑭系發光納米探針,可直接檢測血液樣本中的CTC。
該納米探針的設計是專門識別癌細胞高表達的上皮細胞粘附分子(EpCAM),使信號通過時間分辨的光致發光(TRPL)放大。由于每個細胞內鑭離子標記率高,且TRPL消除了短時間的自發熒光,促進了細胞內鑭離子標記率的提高,這種方法可以直接檢測乳腺癌細胞,檢出限為1個細胞/孔。
在癌癥患者中該技術可以檢測到血液CTCs(≥10個/mL),檢出率為93.9% (14/15)。由于CTC水平與癌癥分期密切相關,此項技術在監測癌癥進展方面具有重要意義。
參考文獻
[1] 趙倩雯, 司徒博, 鄭磊. 循環腫瘤細胞檢測與臨床應用進展[J]. 南方醫科大學學報, 2017(10).
[2] Loeian M S, Aghaei S M, Farhadi F, et al. Liquid biopsy using the nanotube-CTC-chip: capture of invasive CTCs with high purity using preferential adherence in breast cancer patients[J]. Lab on a Chip, 2019, 19(11): 1899-1915.
[3] Cheng Y H, Chen Y C, Lin E, et al. Hydro-Seq enables contamination-free high-throughput single-cell RNA-sequencing for circulating tumor cells[J]. Nature communications, 2019, 10(1): 2163.
[4] Guo H, Song X, Lei W, et al. Direct Detection of Circulating Tumor Cells in Whole Blood Using Time-Resolved Luminescent Lanthanide Nanoprobes[J]. Angewandte Chemie (International ed. in English), 2019.
圖片來源:均來自參考文獻,如有侵權請聯系刪除。
文章來源:國家基因庫大數據平臺(微信公眾號) 作者 :尐尐呅 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。