微流控芯片技術在細胞裂解、計數、凋亡檢測、遷移、單細胞捕獲、細胞間作用的研究與應用
20世紀90年代以來,微流控芯片技術得到了快速發展。由于具有小型化、集成化、高通量、低消耗、分析快速等特點,微流控芯片作為一種新型的生物學研究平臺,能夠提供傳統方法不具備的精細和可控制的細胞研究條件,在細胞生物學研究領域中得到了廣泛關注。本文介紹其在細胞裂解、計數、凋亡檢測、遷移、單細胞捕獲、細胞間作用等方面的研究進展。
1.細胞裂解
細胞裂解是對細胞內物質(核酸、蛋白質、信號小分子等)進行分析的關鍵步驟。根據細胞破裂的原理可將細胞裂解方式分為以下幾種:物理裂解、化學裂解、電裂解。物理方法主要指采用冷凍、滲透壓、剪切力和超聲波等破碎細胞。化學方法則指用酶或表面活性劑處理細胞膜,從而使細胞裂解。電裂解法是使用電脈沖或連續的直流電,將細胞破碎。
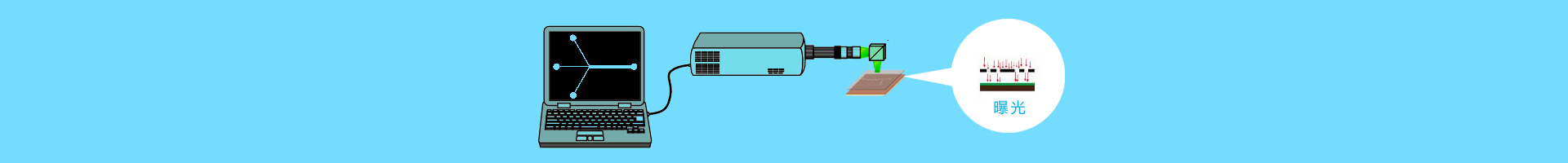
化學裂解中常用的使細胞膜變性的試劑有TritonX-100、鹽酸胍、蛋白酶和十二烷基磺酸鈉(SDS)。圖3A為采用化學試劑進行細胞裂解的芯片,在a-c口分別加入磷酸鹽緩沖液(PBS)和裂解液SDS、TritonX-100,在d口加入胎牛血清,繼而引入要裂解的細胞,細胞在圖中通道交叉處裂解,細胞裂解物在下游被檢測。但化學裂解法會將細胞器膜一起破壞,不適用于亞細胞結構分析,除此之外還需要對細胞裂解物進行分離純化,操作相對麻煩,裂解試劑的使用還可能干擾下游對目標物質的檢測。
細胞膜的雙層結構是絕緣的,但暴露在電場中的細胞會產生一個跨膜電勢,當跨膜電勢超過大約1V時細胞便會發生裂解。Lu等在芯片上設計了鋸齒狀電極,并使用交流電對細胞進行裂解,通過控制電壓大小及頻率,使細胞膜破裂而細胞器膜保持完整,為在亞細胞水平進行分析提供了可能。細胞膜一般需要在較高外加電場強度下(約1000V/cm左右),才能獲得大約1V的跨膜電勢而發生裂解。由于細胞進樣需要在較低電場強度條件下,Lee等通過改變微流控芯片通道的寬度解決了這一問題,如圖3B所示,他們將細胞裂解區通道寬度較其它區域縮小20倍,則該區域的電場強度則達到其它區域的20倍,從而實現了細胞的低場強進樣,高場強裂解。一般的細胞電裂解使用的都是二維電極,對細胞膜產生不均一的力作用,有人采用了高50μm、直徑50μm的三維柱形電極對白細胞進行裂解,可以極大地提高裂解效率。細胞電裂解可在短時間達到裂解效果,最快可達33ms,比SDS裂解的速度快8倍。
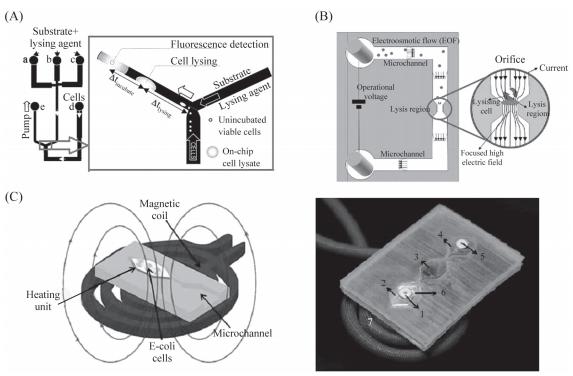
圖3細胞裂解裝置示意圖
A:微流控芯片裂解和孵育HL-60細胞示意圖,裂解液和作用物從a-c口注入,細胞從d口注入,熒光探測器和顯微鏡位于下游交叉處;B:采用低直流電壓連續裂解細胞裝置,微通道寬度為200μm,裂解處孔的寬度為10μm;C:無線感應生熱裂解細胞芯片示意圖,將邊長6mm的六邊形金屬片整合到兩層PDMS中間,整個裝置包括一個入口(1),三個小室(2-4),一個出口(5),加熱元件(6)和感應線圈(7)。
電裂解在高效快速的同時也存在一些弊端,如電極壽命短、操作過程復雜、需要外加電源。為克服這些缺點,Baek等設計了一種無線感應生熱裂解細胞的裝置,如圖3C所示,芯片底部放置一個直徑6mm粗的感應線圈,兩層PDMS中間有厚度為100μm的六邊形金屬薄片,感應線圈通電后,通過電磁感應現象,金屬薄片發熱,進而將上層芯片小室中的細胞裂解。
2.細胞計數
培養的細胞在一般條件下要求有一定的密度才能生長良好,因此要進行細胞計數。細胞計數通常與細胞分選、裂解等功能一起整合到微流控芯片上。對細胞計數,常使用的方法有熒光檢測、數字圖像處理技術(CCD圖像傳感器)和阻抗測量。前兩種方法主要是將流式細胞儀與微流控芯片結合起來,細胞用特殊熒光素標記,受激發后產生熒光,經光電轉換器轉換成電信號計數細胞。利用阻抗測量的方法也可以在芯片上實現對血細胞的計數,當細胞流經檢測區域時,溶液電導率、電容、電阻發生變化,產生脈沖信號,脈沖信號的多少即反應了細胞數量的多少。除此之外,還可在芯片上嵌入一對光纖維,當細胞流經兩纖維之間時,光被擋住,這一信號被捕捉并轉化成電信號,對流過的細胞進行計數。CD4+T淋巴細胞的計數在HIV陽性患者的檢測中起著重要的作用,目前,利用上述方法已經成功實現了在微流控芯片上對CD4+T淋巴細胞的計數,但檢測前需在通道中注入單克隆抗體以捕捉T細胞。Imaad等[58]還設計了一種新穎的裝置來實現細胞的計數,如圖4所示,他們將PDMS與光碟(compactdisc,CD)整合在一起,將二進制數據寫到光盤上,用相應的輸出數據組成音頻文件,將音頻文件刻錄到可錄光碟中,當有細胞出現時便會采集到錯誤數據,以此來實現細胞計數。
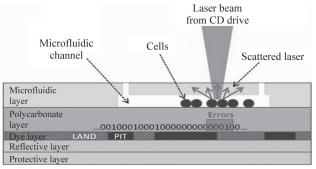
圖4微流控芯片細胞計數研究
裝置包括5層:PDMS層、聚碳酸酯薄層、光敏染料層、金屬反射層和塑料保護層。
3.細胞凋亡
細胞凋亡是一種特殊的細胞程序性或自殺性死亡,通過消除體內不需要的細胞來維持組織穩態和調節免疫應答。增強或抑制細胞凋亡可導致發育缺陷、自身免疫缺陷病和神經退行性病變。細胞凋亡除了在胚胎和大腦發育過程起調節作用外,還與很多疾病有關,包括心臟病和癌癥。伴隨著細胞凋亡過程,細胞形態和功能會發生變化,如細胞皺縮、核質濃縮、線粒體外膜跨膜電勢消失、通透性改變、釋放細胞色素C到胞漿、天冬氨酸特異性半胱氨酸蛋白酶(caspase)激活、細胞膜磷脂酰絲氨酸外翻,最終形成凋亡小體。
細胞凋亡過程中DNA會形成長度為50~300Kb的片段[65],依據這一特征Klepárník等設計了一款芯片用于檢測多柔比星(doxorubicin)誘導的心肌細胞的凋亡,細胞在堿性環境下裂解,用溴化乙錠標記DNA,電泳分離后在共聚焦顯微鏡下觀察DNA片段長度,以此來判斷細胞凋亡的程度。半胱氨酸天冬氨酸蛋白酶(caspase)是一類在天冬氨酸殘基處裂解蛋白質的蛋白酶家族,在細胞凋亡過程中起調節作用。Randall等在微流控芯片上實現了同時捕獲并誘導淋巴細胞凋亡,他們將抗CD-95的抗體粘附在玻璃基底上,連有脂肪酸合成酶(Fas)受體的細胞流經微流控芯片通道時被捕獲,與此同時經由caspases-8途徑誘導淋巴細胞凋亡,被固定在通道表面的細胞被認為經歷細胞凋亡過程。Dai等設計了濃度梯度的芯片檢測細胞凋亡程度,將青色和黃色熒光蛋白用含有caspase-3裂解位點的短肽連接,通過質粒轉染HeLa-C3細胞,然后用不同濃度的依托泊苷(一種治療腫瘤的藥物)處理細胞,凋亡的細胞激活caspase-3,在熒光顯微鏡下觀察到綠色熒光,而未凋亡細胞可觀察到藍色熒光。除此之外,細胞凋亡時細胞膜內側的磷脂酰絲氨酸外翻,鈣磷脂結合蛋白V(AnnexinV)與磷脂酰絲氨酸有高度的親和力,利用這一特性,Zhao等以AnnexinV功能化的量子點為探針,在微流控芯片上檢測經抗癌藥物作用后白血病HL-60細胞的凋亡程度,熒光強度反映了細胞凋亡的程度,在單細胞水平上成功區分了凋亡和非凋亡細胞。
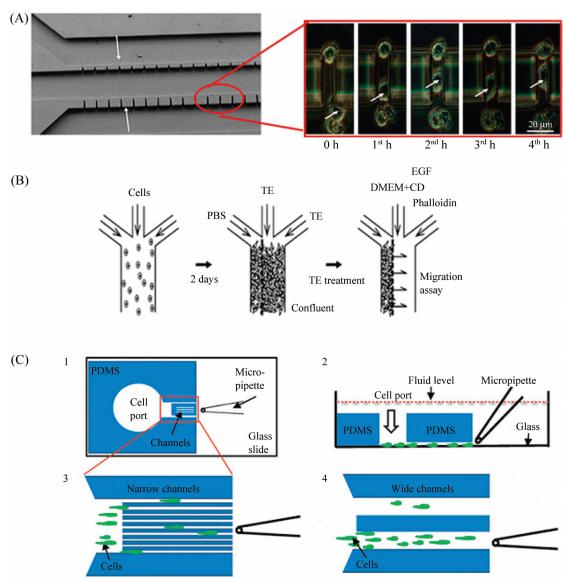
圖5微流控芯片細胞遷移研究
A:左圖為單個HeLa細胞通過微缺口的遷移研究,這個裝置包括3個平行的通道和兩排寬度為3μm和10μm的微缺口,右圖箭頭指示細胞核的位置,HeLa細胞從底部通道向中間通道遷移;B:匯合細胞創造邊緣傷口過程,首先從三個入口灌入細胞,兩天后當細胞匯合到一起時,分別灌注30mLPBS、胰蛋白酶和EDTA混合液,然后再加入表皮生長因子、細胞松弛素D和鬼比環肽;C:用于研究細胞遷移的開放性微流控裝置。1:從底部觀察到的芯片示意圖。PDMS層包括細胞存儲池和微通道,含有cAMP和葉酸混合液的微滴管放在微通道的前方;2:裝置側面觀,細胞從儲液池灌入,在玻璃層表面向微滴管方向移動;3:窄通道區域內細胞遷移示意圖。區域內總共有16個通道,寬度分別為6,8,10,12μm,每隔寬度重復4次;4:兩個寬通道區域內細胞遷移示意圖,每個通道寬度為100μm
4.細胞遷移
細胞遷移也稱細胞運動,指的是細胞在接收到遷移信號或感受到某些物質的濃度梯度后產生的移動。細胞覓食、損傷的痊愈、胚胎發生、免疫、感染和癌癥轉移等生理現象都涉及到細胞的遷移,因此細胞遷移是目前細胞生物學研究的一個重要內容。目前,最常用的研究細胞遷移的方法之一是劃痕法,Liang等設計了一種填充芯片來研究細胞的遷移,芯片由兩層管道組成,下層用來培養細胞,上層管道用來控制液體流動及產生傷痕區域,每隔一段時間拍攝圖像并計算出沒有被細胞填充的區域,借此衡量細胞的遷移速度。Chaw等設計了如圖4A所示的芯片來研究細胞的遷移,芯片共有三個平行的通道,中間通道與另兩個通道間分別有多個寬3μm和10μm的缺口,其中上下兩個通道灌入細胞和基本培養基,而中間通道灌入基本培養基和10%的胎牛血清,在趨化因子的作用下,上下兩層通道中的細胞會按箭頭指示方向運動。Nie等用胰蛋白酶消化產生劃痕,觀察細胞在表皮生長因子等作用下的遷移情況,實驗過程如圖4B所示,首先在三個并行的寬300μm通道灌注胚胎纖維細胞(NIH3T3),待細胞貼壁生長后用胰蛋白酶和EDTA混合液(TE)消化,然后加入基本培養基(DMEM)、表皮生長因子(EGF)、細胞松弛素D(CD)、鬼比環肽(phalloidin),觀察細胞遷移運動。Jowhar等還設計了不同寬度的通道來觀察盤基網柄菌(Dictyosteliumdiscoideum)的遷移活動,通常情況下盤基網柄菌以單細胞形式存在,當食物匱乏時分泌環腺苷酸(cAMP)并在cAMP作用下聚集成多細胞,如圖所示,將饑餓處理的極性細胞和未處理的非極性細胞分別用熒光標記,混合后引入到細胞儲液池,在通道另一側用微滴灌注入cAMP和葉酸混合液,觀察兩種細胞的遷移速率和遷移路徑。
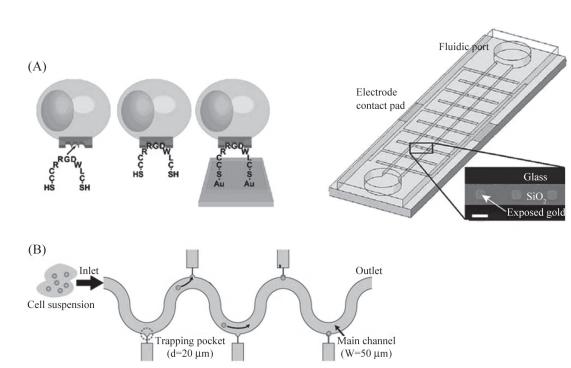
圖6單細胞捕獲示意圖
A:左圖為精氨酸-甘氨酸-天冬氨酸肽介導的細胞硫醇化過程。兩端均含有巰基的九肽與CHO細胞表面結合,然后巰基官能團與金電極表面結合,捕獲細胞。右圖為整體單細胞捕獲芯片示意圖,當電場強度為50V/cm時,細胞被捕獲在相應的交錯電極;B:用于細胞捕獲的蛇形通道結構示意圖。細胞懸液從進口注入,單個細胞相繼被捕獲在捕獲口袋,主通道寬50μm,捕獲口袋直徑20μm。
5.單細胞捕獲
在傳統的對細胞增殖、分化及細胞對外界刺激反應的研究中,通常把細胞樣品看成是均一穩定的,而事實上細胞通常是異質性的,所以單細胞分析在理解細胞個體間的差異顯得尤為重要。在單細胞水平進行研究相對于傳統的細胞生物技術及分析方法更具優勢,因為其能更精確、直接地觀察到細胞、亞細胞水平的動態和不連續過程,使蛋白質定位及動力學的研究成為可能,同時可以檢測單個細胞對相同的信號分子的不同反應。單細胞水平研究的前提是實現單細胞捕獲,進而才能對其內含物進行分析或實現單細胞操控。目前,已經有很多成功應用的實例,比如Nicholas等設計了電場驅動單細胞捕獲的裝置,如圖5A所示,中國倉鼠卵巢細胞(CHOcells)用合成的含有巰基的九肽(CCRRGDWLC)進行標記,然后將細胞懸浮液引入到微通道中,被標記的細胞與金電極表面結合形成金硫鍵,從而達到細胞捕獲的效果。Takahiro等設計了捕獲口袋來實現單細胞捕獲,如圖5B所示,蛇形通道兩側有直徑20μm的捕獲口袋,當細胞懸浮液流經通道主通道時,會有部分細胞被捕獲,進而進行熒光標記、細胞裂解及內含物的檢測。就目前看來,微流控芯片上進行單細胞操作有著非常好的應用前景,比如對神經細胞之間遞質的傳遞,體外受精以及細胞之間相互作用的研究等。
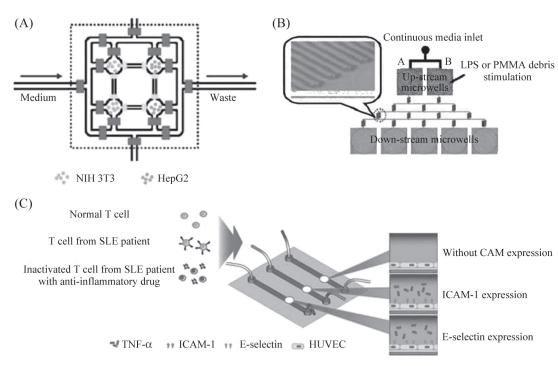
圖7細胞間相互作用研究示意圖
A:NIH3T3與HepG2共培養示意圖,上下兩個通道用于灌注細胞,左邊通道用于培養基的注入,右側通道用于代謝廢物的流出;B:巨噬細胞和成骨細胞共培養示意圖,巨噬細胞位于上游培養區,成骨細胞位于下游培養區;C:T細胞與內皮細胞相互作用研究示意圖,首先將HUVECs灌注到芯片上,并用腫瘤壞死因子(TNF-α)刺激誘導表面分子表達,T細胞用異硫氰酸熒光素(FITC)連接的CD3抗體標記,在熒光顯微鏡下觀察T細胞,SLE:系統性紅斑狼瘡。
6.細胞間相互作用
細胞間相互作用是指細胞間的直接作用,在多細胞生物的發育及功能發揮中起著重要作用,并且在衰老及病理條件下可以維持體內的穩態。細胞間相互作用參與許多生理及病理過程,例如胚胎發育、傷口愈合、腫瘤侵襲和轉移等。微流控芯片具有設計靈活的特點,在大量的微通道中可同時培養多種細胞,通過對3D胞外基質的引入可實時監測和控制生化因子和信號分子的產生及其濃度,更適合細胞間相互作用的研究。目前微流控芯片研究細胞間相互作用最常用的方法是細胞共培養。Liu等用芯片實現胚胎成纖維細胞(NIH3T3)和肝癌細胞(HepG2)的共培養,如圖7A所示,兩種細胞分別用不同的熒光分子標記,打開通道閥門,給予充足的營養,在熒光顯微鏡下可觀察到NIH3T3向HepG2方向移動。Wei等設計了一種能更精確反映細胞間相互作用的微流控細胞共培養體系,如圖7B所示,體系包括上游和下游細胞培養區,上游細胞培養區用來培養巨噬細胞,當用脂多糖(LPS)或聚甲基丙烯酸甲酯(PMMA)給予刺激時,巨噬細胞分泌白細胞介素-1β和腫瘤壞死因子-α,這兩種代謝產物通過微通道網絡結構形成濃度梯度,作用于下游的成骨細胞,促進成骨細胞分泌前列腺素E2。白細胞與內皮細胞的相互作用對白細胞在免疫系統中的遷移及功能發揮起著重要作用,而這兩種細胞的相互作用需要細胞粘附分子(CAM)的參與,為了研究這兩種細胞間的作用,Park等設計如圖7C所示芯片,通過CAM的表達量來研究T淋巴細胞(白細胞的一種)與人臍靜脈內皮細胞(HUVECs)之間的相互作用。
微流控芯片技術自20世紀90年代出現以后,隨著生物、材料、化學、物理工程和電子工程等學科的介入,目前已取得了巨大的發展,其最終目的是建立多功能芯片實驗室。微流控芯片技術正以其獨特的優勢越來越多地應用到細胞生物學研究中,其不僅可以為細胞提供可控制的生存微環境,與其他分析方法結合檢測細胞內生化過程,而且在細胞個體、細胞群體和多細胞生命體三個層次對細胞的生命活動進行深入研究。另一方面,微流控芯片仍處于發展初期,許多方面的技術還不成熟,如不能進行長期細胞培養;細胞三維培養中一些水凝膠和粘連蛋白的引入可能阻塞通道和妨礙物質傳輸;電裂解細胞時產生的焦耳熱和氣泡會影響細胞生長和代謝等。目前微流控芯片大多處于實驗室概念化論證階段,尚未達到理想的商業化和通用化程度;對微流控芯片技術了解不多的生物研究人員,應用起來還有一定的困難。但是,基于微流控芯片的突出優點和人們對新技術的需求,我們相信微流控芯片細胞實驗室將成為細胞生物學研究的重要平臺。
(文章節選自:微流控芯片技術在細胞生物學研究中的應用進展作者:姚琳 白亮 吳亮其 丁永勝*轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除)
標簽: 細胞裂解; 細胞計數 細胞裂解 細胞凋亡 細胞遷移 單細 胞捕獲 細胞間作用