微液滴中的單細(xì)胞封裝
微液滴中的單細(xì)胞包封主要是通過流體動(dòng)力學(xué)和表面張力操縱來實(shí)現(xiàn)的。液滴尺寸由連續(xù)相的粘度、界面張力、微通道尺寸以及分散相和連續(xù)相的流速?zèng)Q定,液滴直徑從幾十微米到幾百微米不等。單細(xì)胞微滴具有高通量和小尺寸的特點(diǎn),使其適用于高通量單細(xì)胞分析。然而,單細(xì)胞的包封通常是隨機(jī)的,特別是當(dāng)基于通常用于單細(xì)胞分析的被動(dòng)液滴生成方法時(shí)。需要加強(qiáng)對(duì)單細(xì)胞包囊的控制。為了提高實(shí)際應(yīng)用的封裝效率,通常會(huì)進(jìn)行隨機(jī)封裝,然后根據(jù)工藝要求進(jìn)行進(jìn)一步篩選。此外,通道結(jié)構(gòu)經(jīng)過定制,以確保細(xì)胞的最佳排列和封裝。
隨機(jī)單細(xì)胞包封使用微流體液滴技術(shù)生產(chǎn)液滴面臨著一個(gè)固有的復(fù)雜性,即溶液中細(xì)胞的分布通常是不均勻的,包封是一個(gè)隨機(jī)過程。因此,無限稀釋的細(xì)胞懸浮液中每個(gè)液滴封裝的細(xì)胞數(shù)量將遵循泊松分布,其中液滴中的細(xì)胞數(shù)量由液滴的大小和懸浮液中細(xì)胞的密度決定。增加細(xì)胞密度或液滴大小會(huì)增加給定液滴包封多個(gè)細(xì)胞的機(jī)會(huì)。例如,在細(xì)胞懸浮液濃度為7.5×105個(gè)細(xì)胞/mL時(shí),在體積為33、180、320 pL時(shí),含有多個(gè)細(xì)胞的概率分別為0.03、0.83和2.45%(圖4A)。預(yù)測(cè)的泊松分布與液滴形成后獲得的實(shí)際分布非常一致。一般來說,大多數(shù)液滴會(huì)有一個(gè)細(xì)胞或沒有細(xì)胞,只有少數(shù)液滴會(huì)包含多個(gè)細(xì)胞。隨機(jī)確定的包封在液滴內(nèi)的細(xì)胞數(shù)量的變化將對(duì)研究單個(gè)細(xì)胞的能力產(chǎn)生重大影響。
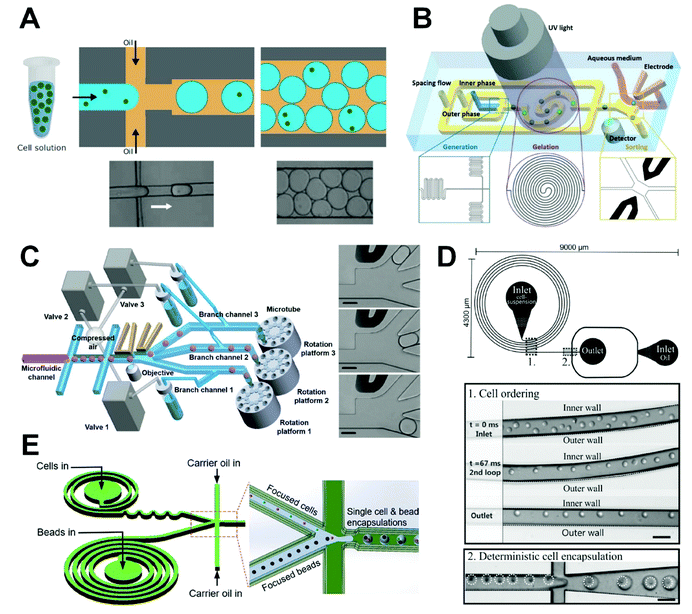
在隨機(jī)包封方法中,每個(gè)液滴的細(xì)胞數(shù)量取決于細(xì)胞懸浮液的初始濃度和液滴體積,但將遵循高度隨機(jī)的分布,其中單細(xì)胞液滴的比例較低。因此,必須進(jìn)一步加強(qiáng)控制單個(gè)液滴內(nèi)包封的細(xì)胞數(shù)量的程度。為了提高單細(xì)胞包封的效率,一些研究人員采用了隨機(jī)包封后分選的方法。例如,Navi等人提出了一種使用流聚焦微流體裝置在水滴中產(chǎn)生水的方法。87在他們的裝置中,鐵磁流體被集成到全水滴微流體系統(tǒng)中,以實(shí)現(xiàn)單細(xì)胞包封和空液滴的抗磁性分離。與現(xiàn)有平臺(tái)相比,他們的平臺(tái)的主要優(yōu)勢(shì)是良好的生物相容性,不會(huì)對(duì)細(xì)胞造成傷害,芯片簡(jiǎn)單易操作。通過使用反磁力來操縱細(xì)胞包封液滴,液滴不需要被磁化,因此細(xì)胞不會(huì)與磁性材料直接接觸,從而能夠以100%的分離純度進(jìn)行未標(biāo)記的細(xì)胞操作。這種簡(jiǎn)單且生物相容的微流體平臺(tái)非常適用于單細(xì)胞分析。此外,Nan等人引入了一種微流體系統(tǒng)來生產(chǎn)和分類單細(xì)胞微膠囊(圖4B),88通過該系統(tǒng),他們能夠在微流體裝置中實(shí)現(xiàn)微滴和微凝膠的高通量制備。重要的是,芯片上的分選電極用于完成單細(xì)胞微膠囊的選擇,同時(shí)將其轉(zhuǎn)移到培養(yǎng)基中。在每毫升3.05×106個(gè)細(xì)胞的細(xì)胞密度和50μm的液滴直徑下,它們實(shí)現(xiàn)了16%的單細(xì)胞包封率。分選后,單細(xì)胞包封率提高到80%以上。該方法可用于整合液滴凝膠化、單細(xì)胞負(fù)載微凝膠分選和轉(zhuǎn)移到培養(yǎng)基中,以實(shí)現(xiàn)單細(xì)胞水平的高通量分析,從而全面評(píng)估細(xì)胞異質(zhì)性。最近,Shum的團(tuán)隊(duì)開發(fā)了一種基于微流控液滴和熒光激活分選技術(shù)組合的按需液滴收集系統(tǒng),該系統(tǒng)可以連續(xù)定量地將所需的液滴收集到微管中,而不會(huì)造成明顯的樣品損失或微流控中斷(圖4C)。具體來說,他們的方法允許在液滴產(chǎn)生后交替地對(duì)每個(gè)分支通道進(jìn)行分選、分布和收集,以實(shí)現(xiàn)單細(xì)胞液滴的連續(xù)收集。然后將包封的單細(xì)胞液滴有效地捕獲在培養(yǎng)板上,并進(jìn)一步培養(yǎng)以研究細(xì)胞行為并充分分析單個(gè)細(xì)胞的特異性。通過使用熒光激活液滴分選和閥驅(qū)動(dòng)分配,該方法可以在200 Hz以上的頻率下篩選單個(gè)細(xì)胞,單個(gè)細(xì)胞的包封效率和回收率分別為98.5%和99%。這種方法比傳統(tǒng)的人工細(xì)胞選擇和激光捕獲顯微切割技術(shù)更有效,在單細(xì)胞水平分析任務(wù)中具有廣闊的應(yīng)用前景,如免疫學(xué)中的細(xì)胞因子檢測(cè)、蛋白質(zhì)組學(xué)中的質(zhì)譜和轉(zhuǎn)錄組的全基因組測(cè)序。
受控的單細(xì)胞包封如前所述,懸浮液中的細(xì)胞隨機(jī)包封成液滴的過程結(jié)果通常遵循泊松分布,這通常會(huì)導(dǎo)致相對(duì)較低的單細(xì)胞包封率。為了提高單細(xì)胞包封效率,可以在彎曲的微通道中使用慣性測(cè)序?qū)蝹€(gè)細(xì)胞包封在液滴中,通過將慣性力和Dean力均勻地結(jié)合到空間細(xì)胞的過程。通過將細(xì)胞流動(dòng)的周期性與液滴的產(chǎn)生相匹配,可以減少空液滴和多細(xì)胞液滴的數(shù)量,提高單細(xì)胞的包封效率。例如,Edd等人報(bào)道了高縱橫比微通道中液滴對(duì)單個(gè)細(xì)胞的順序包封。在他們的研究中,細(xì)胞自組織成兩股均勻間隔的流,單細(xì)胞直徑占通道寬度的一半以上。這確保了設(shè)計(jì)的通道寬度只能容納單行細(xì)胞,因此細(xì)胞進(jìn)入頻率與液滴產(chǎn)生頻率一致。這種方法可以通過克服泊松分布的固有局限性來有效地提高封裝精度,以確保幾乎每個(gè)液滴都包含一個(gè)細(xì)胞,從而實(shí)現(xiàn)高封裝效率(97.9%).
Kemna等人率先使用Dean流形成單細(xì)胞排列,隨后進(jìn)行單細(xì)胞包封(圖4D)。 Dean流可以誘導(dǎo)細(xì)胞在平衡的位置聚集,以實(shí)現(xiàn)所需的空間排列,確保細(xì)胞流動(dòng)周期與液滴產(chǎn)生頻率一致,并將包封效率提高到77%。他們的方法利用微觀結(jié)構(gòu)來控制細(xì)胞的規(guī)則排列,然后完成單細(xì)胞的封裝,有效地提高了單細(xì)胞液滴的比例。然而,這不僅需要控制Dean流的形成,還需要細(xì)胞和液滴頻率的同步,這很難實(shí)現(xiàn)。
他的團(tuán)隊(duì)將螺旋和蛇形通道結(jié)合起來,有效地聚焦細(xì)胞和微珠。他們使用他們的方法包封條形碼微珠和人類小鼠細(xì)胞,然后通過測(cè)序表征細(xì)胞異質(zhì)性(圖4E)。使用這種方法,與傳統(tǒng)的Drop-seq設(shè)備和僅用于聚焦微珠的設(shè)備相比,他們的細(xì)胞利用率分別提高了300%和40%。結(jié)果支持其微流控芯片的操作效率得到提高。這種芯片設(shè)計(jì)具有實(shí)現(xiàn)高效單細(xì)胞表達(dá)譜的巨大潛力。
水凝膠中的單細(xì)胞包封
除了模擬三維(3D)微環(huán)境以支持細(xì)胞的活動(dòng)和功能外,將單細(xì)胞包裹在微尺度水凝膠中還可以作為進(jìn)行獨(dú)立細(xì)胞操作和監(jiān)測(cè)的良好工具,這對(duì)于探索類體內(nèi)微環(huán)境中的單細(xì)胞活動(dòng)至關(guān)重要。與單細(xì)胞包封的液滴不同,微凝膠可以形成3D網(wǎng)絡(luò)結(jié)構(gòu),其形態(tài)可以通過調(diào)節(jié)凝膠單體或聚合物的濃度來控制。這確保了氧氣、營(yíng)養(yǎng)物質(zhì)和生長(zhǎng)因子的供應(yīng),以及細(xì)胞代謝廢物的及時(shí)排出,這使得在凝膠微球中培養(yǎng)細(xì)胞一段時(shí)間成為可能。通過應(yīng)用適當(dāng)?shù)幕瘜W(xué)或物理方法,液滴中的未固化凝膠可以被激活轉(zhuǎn)化為凝膠微球。化學(xué)凝膠化可以通過光誘導(dǎo)交聯(lián)、氧化還原誘導(dǎo)聚合或分子間化學(xué)交聯(lián)反應(yīng)來實(shí)現(xiàn)。雖然通過化學(xué)凝膠化制備的水凝膠具有更高的穩(wěn)定性、更長(zhǎng)的耐用性和更好的機(jī)械性能,但使用化學(xué)交聯(lián)劑可能會(huì)導(dǎo)致細(xì)胞毒性,一些化學(xué)反應(yīng)的低特異性可能會(huì)導(dǎo)致與蛋白質(zhì)和細(xì)胞的意外相互作用。物理凝膠化可以經(jīng)由熱介導(dǎo)的溶膠-凝膠轉(zhuǎn)變或離子之間的物理交聯(lián)反應(yīng)來實(shí)現(xiàn)。在熱產(chǎn)生的凝膠化過程中,當(dāng)溫度高于凝膠化溫度時(shí),含有聚合物的液滴處于液態(tài),將溫度降低到凝膠化溫度以下會(huì)導(dǎo)致聚合物的線性分子聚合。形成凝膠網(wǎng)絡(luò)結(jié)構(gòu),誘導(dǎo)液滴固化成凝膠微球。另一種凝膠化方法是基于靜電相互作用的物理交聯(lián)。一種常見的物理交聯(lián)凝膠化方法是通過藻酸鈉葡萄糖單元中的鈣離子和羧酸基團(tuán)的螯合將藻酸鈉轉(zhuǎn)化為藻酸鈣凝膠。雖然物理凝膠化過程可以在溫和的條件下進(jìn)行,但物理水凝膠網(wǎng)絡(luò)在組織內(nèi)的機(jī)械強(qiáng)度通常較低,穩(wěn)定性較差。因此,物理方法更適合包封細(xì)胞,并且比化學(xué)交聯(lián)方法具有更好的生物相容性。兩種類型的材料——合成聚合物和天然聚合物——用于生產(chǎn)包封單細(xì)胞的水凝膠微球。
使用合成聚合物進(jìn)行包封在微流控液滴技術(shù)中,合成聚合物被用作生產(chǎn)細(xì)胞包封凝膠微球的材料,該微球可以通過化學(xué)修飾直接控制細(xì)胞微環(huán)境。常用的合成聚合物包括聚(N-異丙基丙烯酰胺)和聚乙二醇二丙烯酸酯。合成聚合物在分子量、結(jié)構(gòu)和交聯(lián)密度方面具有可調(diào)節(jié)的性能,可用于生產(chǎn)具有不同機(jī)械性能的凝膠微球,通常比天然水凝膠更強(qiáng)。含有薄(幾微米)半滲透外殼的合成水凝膠膠囊與基因組擴(kuò)增等多步分子生物學(xué)檢測(cè)兼容。然而,這些合成微凝膠是不可生物降解的。
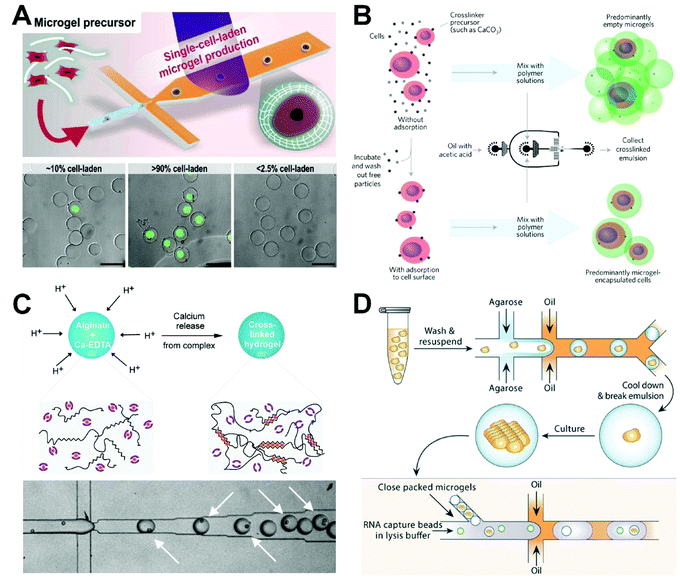
一般來說,通過紫外線聚合的合成聚合物被應(yīng)用于形成凝膠微球以包封細(xì)胞。含有光引發(fā)劑、交聯(lián)劑和單體的細(xì)胞懸浮液用作分散相。微滴在微流控芯片中產(chǎn)生后,光引發(fā)劑在紫外光照射下,在交聯(lián)劑的作用下促進(jìn)單體的交聯(lián)反應(yīng),產(chǎn)生凝膠微球。Kamperman等人使用聚乙二醇二丙烯酸酯作為原料,在微流體流聚焦裝置中以1 kHz的包封速度形成包封有多能性人間充質(zhì)干細(xì)胞或牛軟骨細(xì)胞的微滴(圖5A)。通過下游通道中的外部紫外光源對(duì)微滴進(jìn)行光交聯(lián),以制備細(xì)胞負(fù)載微凝膠并保持高細(xì)胞活性。通過流式細(xì)胞術(shù)分選的單細(xì)胞微凝膠(純度>90%)然后與聚乙二醇二丙烯酸酯和藻酸鹽等不同的生物相容性材料混合,以創(chuàng)建各種模塊化生物墨水,可用于3D打印,以單細(xì)胞分辨率重建細(xì)胞微環(huán)境。然而,紫外線照射對(duì)細(xì)胞有一些毒性作用。解決這個(gè)問題有兩種潛在的方法:(1)可以減少紫外線照射的暴露時(shí)間或調(diào)整紫外線波長(zhǎng);(2) 可以開發(fā)新的聚合方法來避免細(xì)胞損傷。
使用天然聚合物進(jìn)行封裝與合成聚合物不同,天然聚合物來源于生物體自身產(chǎn)生的代謝物。近年來,天然聚合物因其良好的生物相容性和溫和的聚合條件而被廣泛應(yīng)用于細(xì)胞封裝。用于單細(xì)胞包封的天然聚合物包括海藻酸鈉、瓊脂糖、明膠、膠原蛋白、和透明質(zhì)酸,其中海藻酸鈉,瓊脂糖和明膠是最常用的95種。
海藻酸鹽是一種從褐藻中提取的水溶性線性大分子多糖化合物,由不同比例的β-d-manuronic和α-l-古洛糖醛酸單元形成。108古洛糖核酸單元中的羧基可以與鈣、鋇和鎂等二價(jià)陽(yáng)離子反應(yīng),導(dǎo)致快速凝膠形成。由于海藻酸鈉無毒,凝膠化模式溫和,生物相容性良好,因此通常用于制備凝膠微球來包封細(xì)胞,可應(yīng)用于細(xì)胞生物學(xué)、組織工程、藥物篩選和其他生物領(lǐng)域。一般來說,有兩種方法可以控制海藻酸鈉的凝膠化過程:外部凝膠化,其中交聯(lián)劑擴(kuò)散到液滴外部;以及內(nèi)部凝膠化,其中交聯(lián)劑被加載到水相中并由刺激觸發(fā)。
Liao等人使用外部凝膠化將細(xì)胞包封在生物相容性海藻酸鈉液滴中,并將其包封在油滴中,形成基于雙流聚焦區(qū)域的雙乳液。油擴(kuò)散的Ca2+進(jìn)入海藻酸鈉形成微凝膠。盡管這種凝膠化方法有助于保持高細(xì)胞存活率,但由于鈣擴(kuò)散的困難,微凝膠無法在短時(shí)間內(nèi)完全凝膠化。為了解決不完全凝膠化的問題,研究人員提出了一種液滴融合方法來更好地制備單細(xì)胞微凝膠。Liu等人報(bào)道了一種基于微流控液滴技術(shù)制備單細(xì)胞微凝膠的新方法。他們使用含有2%海藻酸鈉或1%氯化鈣溶液的細(xì)胞懸浮液作為分散相,大豆油作為連續(xù)相,產(chǎn)生成對(duì)的不同液滴。兩個(gè)液滴在下游相遇并融合,Ca2+使海藻酸鈉凝膠化,形成包封細(xì)胞的凝膠微球。然而,由于交聯(lián)發(fā)生在鈣離子均勻分布之前,微凝膠的均勻性降低。此外,融合通常會(huì)導(dǎo)致最終交聯(lián)的藻酸鹽微凝膠的體積增加。
穆尼的團(tuán)隊(duì)開發(fā)了一種內(nèi)部凝膠化方法,使用流動(dòng)聚焦微流體裝置制備單細(xì)胞微凝膠(圖5B)。具體來說,細(xì)胞懸浮在碳酸鈣納米顆粒溶液中,這些納米顆粒被吸附在細(xì)胞表面。在洗滌多余的納米顆粒后,將細(xì)胞懸浮液與作為分散相的海藻酸鈉溶液混合,形成油包水珠。由于油相中存在乙酸,H+擴(kuò)散釋放鈣,鈣介導(dǎo)海藻酸鈉凝膠化形成微球。盡管這種方法可以在不進(jìn)行額外下游處理的情況下顯著提高單細(xì)胞包封的效率,但只有含有細(xì)胞的液滴會(huì)被交聯(lián),所得凝膠微球的結(jié)構(gòu)也會(huì)不均勻。為了解決凝膠微球結(jié)構(gòu)不均勻的問題,Utech等人提出了一種使用微流控液滴技術(shù)制備具有均勻結(jié)構(gòu)的單分散海藻酸鹽微凝膠的方法(圖5C)。使用水溶性鈣絡(luò)合物作為交聯(lián)前體,可以使鈣離子在產(chǎn)生的海藻酸鹽液滴內(nèi)均勻分布。具體來說,在將單個(gè)間充質(zhì)干細(xì)胞包封在液滴中后,將乙酸加入連續(xù)相中以解離復(fù)合物并釋放鈣離子,鈣離子又與海藻酸鈉反應(yīng)形成結(jié)構(gòu)均勻的海藻酸鈉微凝膠。
瓊脂糖是一種從紅藻細(xì)胞壁中提取的天然線性多糖,由β-d-半乳糖和α-3,6-半乳糖苷組成。它是一種典型的天然聚合物,在37°C的溶液中由溫度引發(fā),然后在20°C下交聯(lián)成凝膠。瓊脂糖,特別是低熔點(diǎn)瓊脂糖,因其良好的生物相容性和溫和的凝膠化條件而適用于細(xì)胞包封實(shí)驗(yàn)。在他們的過程中,用低熔點(diǎn)瓊脂糖包封單個(gè)酵母細(xì)胞以形成瓊脂糖液滴,將其收集到放置在冰上的50mL離心管中以形成瓊脂糖微凝膠。將瓊脂糖微凝膠重新懸浮在合適的培養(yǎng)基中過夜培養(yǎng),形成單酵母細(xì)胞集落微凝膠,這為集落深度測(cè)序提供了足夠的RNA,并減少了單個(gè)單細(xì)胞基因表達(dá)譜中出現(xiàn)的錯(cuò)誤。
明膠是甘氨酸、脯氨酸和羥脯氨酸等氨基酸的混合物,通過皮膚、骨骼和肌腱等結(jié)締組織中膠原蛋白的降解形成。明膠也通過溫度誘導(dǎo)聚合形成網(wǎng)絡(luò)結(jié)構(gòu)。Li等人使用明膠作為水凝膠材料來包封微藻細(xì)胞(E.gracilis和C.reinhardtii)進(jìn)行單細(xì)胞培養(yǎng)和篩選。基于流式細(xì)胞術(shù)輔助分選,可以選擇具有快速生物量生產(chǎn)力或高脂質(zhì)生產(chǎn)力的培養(yǎng)的微藻單克隆群體進(jìn)行多重篩選。特別是,熱響應(yīng)性明膠可以在20-27°C的范圍內(nèi)維持細(xì)胞的液體培養(yǎng),在4°C下發(fā)生凝膠化形成微凝膠,用于分選,當(dāng)溫度升高到35°C時(shí),發(fā)生脫膠以有效恢復(fù)細(xì)胞。雖然整個(gè)過程不會(huì)對(duì)細(xì)胞造成傷害,但復(fù)雜的凝膠化機(jī)制有一定的缺點(diǎn),包括凝膠化時(shí)間長(zhǎng),通常需要幾個(gè)小時(shí)才能形成中等硬度的凝膠,導(dǎo)致實(shí)驗(yàn)效率低。為了克服這一缺點(diǎn),研究人員對(duì)明膠進(jìn)行了化學(xué)改性。Nan等人使用甲基丙烯酸明膠,一種光學(xué)交聯(lián)明膠,可以通過紫外線照射快速凝膠化。他們的芯片上凝膠技術(shù)與微流控液滴技術(shù)無縫結(jié)合,實(shí)現(xiàn)了凝膠微球的高通量制備。
為了更好地模擬體內(nèi)細(xì)胞的生理環(huán)境,研究人員使用多組分材料(如明膠和膠原蛋白)制備單細(xì)胞微凝膠。當(dāng)單獨(dú)用作支架時(shí),膠原蛋白的機(jī)械性能較差,但添加明膠可以通過支持細(xì)胞粘附來改善凝膠的機(jī)械性能,同時(shí)保持膠原蛋白的調(diào)節(jié)性能。微凝膠的材料特性(剛度、孔徑、交聯(lián)度和膨脹率)可以通過改變液滴的組成和交聯(lián)時(shí)間來控制。包封的細(xì)胞存活率高度依賴于交聯(lián)時(shí)間,較長(zhǎng)的交聯(lián)時(shí)間會(huì)導(dǎo)致細(xì)胞存活率降低。交聯(lián)時(shí)間為8分鐘的微凝膠中約70%的細(xì)胞能夠存活一周,表明凝膠珠的形成不會(huì)損傷細(xì)胞,并可能用于未來的單細(xì)胞分析。此外,微凝膠中的單細(xì)胞大多偏離中心。為了防止細(xì)胞逃逸并實(shí)現(xiàn)特殊的操作目的(如長(zhǎng)期細(xì)胞培養(yǎng)),Kamperman等人提出了一種微流控液滴方法,通過延遲酶交聯(lián)將單細(xì)胞定中心在由透明質(zhì)酸和葡聚糖組成的微凝膠中。這種單細(xì)胞定心實(shí)現(xiàn)了細(xì)胞從微凝膠逃逸的持續(xù)預(yù)防(超過28天),大大提高了單細(xì)胞長(zhǎng)期培養(yǎng)的可靠性。
免責(zé)聲明:文章來源網(wǎng)絡(luò) 以傳播知識(shí)、有益學(xué)習(xí)和研究為宗旨。轉(zhuǎn)載僅供參考學(xué)習(xí)及傳遞有用信息,版權(quán)歸原作者所有,如侵犯權(quán)益,請(qǐng)聯(lián)系刪除。
標(biāo)簽: 微液滴