可通過快速篩選允許細胞來分離病毒的微流控細胞芯片
摘要
病毒鑒定不僅是病毒性傳染病早期診斷的前提,也是有效預防流行病的前提。根據科赫假設,成功培養是識別病毒的黃金標準。然而,這需要篩選一種寬松的細胞系,這在傳統上是時間、試劑和勞動密集型的。本文報道了一種簡單易操作的微流控芯片,該芯片通過接種多種細胞系并平行培養而形成,可用于病毒培養和病毒允許的宿主細胞篩選。該芯片通過感染兩種已知病毒進行測試,即腸道病毒 71 (EV71) 和流感病毒 H1N1。EV71 和 H1N1 感染分別在 RD 和 MDCK 細胞中引起顯著的細胞病變效應 (CPE),表明基于這種微流控細胞芯片的病毒培養可以替代傳統的基于平板的培養方法,并重現病毒感染引起的典型 CPE。使用這種微流控細胞芯片方法進行病毒培養,可以以高通量、自動和前所未有的快速方式識別新出現的病毒。
1. 引言
新發和再發傳染病,如嚴重急性呼吸系統綜合癥冠狀病毒(SARS-CoV)-2 和 SARS-CoV對人類構成致命威脅。此外,2013-2016 年西非埃博拉病毒疫情導致 28,000 多例病例,占相關死亡人數的一半以上。在感染病毒性疾病的早期階段,避免患者惡化和預防其他致命并發癥的先決條件是確認病毒類型或亞型。只有在確定病毒種類后,我們才能利用現有知識采取措施。因此,病毒的快速識別對于早期診斷和疫情防控至關重要。各種方法,包括血凝抑制和中和試驗,核酸擴增,免疫熒光測定,酶聯免疫吸附測定和下一代測序,通常應用于病毒的早期診斷。目前,定量逆轉錄-PCR是病毒早期診斷的首選方法,因為它具有高特異性和高靈敏度的優點。然而,根據Koch假設,基于活病毒細胞培養的噬菌斑測定是病毒鑒定和診斷的金標準。對于新出現的病毒,應用斑塊檢測的主要問題是需要篩選病毒允許的細胞系。使用平板或培養皿進行細胞和病毒培養的傳統方法耗時且耗費試劑,勞動密集型且靈敏度低。
基于微機電系統(MEMS)的微流控芯片可以處理微/納升尺度的流體,因此需要的試劑和臨床樣本量要少得多。更重要的是,通過使用微流控細胞芯片,可以實現具有不同細胞系和培養條件的高通量并行測試。特別是當微流控細胞芯片與處理和控制設備集成時,創建自動高通量培養和篩選系統將成為可能。
本文設計了由聚甲基丙烯酸甲酯(PMMA)上下蓋板、聚乳酸(PLA)框架、聚二甲基硅氧烷(PDMS)芯片和底部金屬框架組裝而成的微流控芯片,用于培養不同的細胞系,以篩選病毒允許的細胞。在PDMS芯片上同時培養用于病毒培養的5種常見宿主細胞系A549、BHK21、Vero、RD和MDCK。通過逐漸改變培養基含量,使不同的細胞系適應相同的培養基。然后,以腸道病毒71型(EV71)和流感病毒H1N1為模型病毒,在微流控培養系統中測試細胞芯片,以篩選病毒允許的細胞。與傳統的實驗室培養方法相比,該細胞芯片可以重現被測病毒的典型細胞病變效應(CPE),并具有允許篩選多種潛在宿主細胞系以獲得最佳病毒允許細胞系的額外優勢。這項研究為開發高通量細胞培養芯片鋪平了道路,這些芯片將有助于有效的病毒分離和抗病毒藥物篩選。
2.材料與方法
2.1. 設備設計與生成
微流控芯片由上下芯片蓋、芯片框架和PDMS培養芯片組成。上下芯片蓋板通過激光切割由PMMA板預制而成,金屬框架由鋁板通過計算機數控(CNC)加工直接制造而成。使用桌面 delta RepRap 3D 打印機 3D 打印尺寸與 PDMS 培養芯片尺寸相對應的 PLA 框架。器件設計和組裝的詳細原理圖如圖1所示。
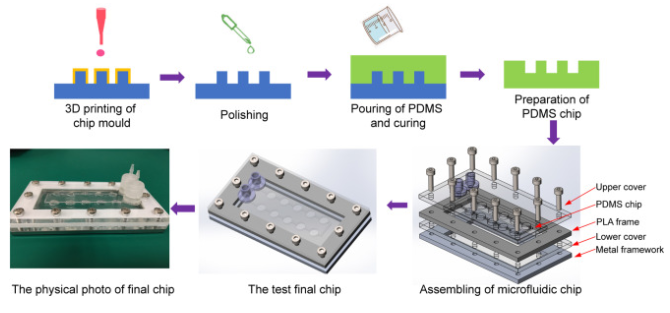
圖 1.微流控芯片設計與制造示意圖.用于制造微流控芯片的定制模具技術的工藝。
首先,通過SolidWorks設計PDMS細胞培養芯片模具,并將設計文件轉換為STL文件,由3D打印機識別。其次,PDMS芯片模具通過DLP或SLA3D打印機在不到一個小時的時間內實現,所得打印模具經過物理或化學拋光,產生光滑的槽面。第三,將脫氣的PDMS預混料(Sylgard 184)倒入模具中,將模具置于70°C的烘箱中1 h,使液體PDMS固化。然后緩慢而小心地將固化的PDMS芯片從芯片模具中剝離。組裝微流控芯片后的最后一步,是用螺絲密封芯片并安裝入口/出口連接器。
2.2. 研究中使用的細胞系和病毒株
本研究中使用的所有細胞系均購自美國組織型培養保藏中心(ATCC,美國)。使用以下五種哺乳動物細胞系進行研究:人腺癌肺泡基底上皮細胞(A549,CCL-185),非洲綠猴腎細胞(Vero,CCL-81),Madin-Darby犬腎上皮細胞(MDCK,CCL-34),人橫紋肌肉瘤細胞(RD,CCL-136)和倉鼠腎成纖維細胞(BHK-21,CCL-10)。為了維持,BHK-21、MDCK和RD細胞在補充有10%胎牛血清(FBS,10099-141C,Gibco)和100單位/ mL青霉素 - 鏈霉素的最小必需培養基(MEM,41500,Gibco,Thornton,Australia)中培養,在37°C的5%CO 2氣氛中;在相同條件下將 A549 和 Vero 細胞維持在 DMEM 中。對于感染,EV71 使用含有 1% FBS 的 Dulbecco 改良的 Eagle 培養基(DMEM,12800,Gibco),將含有 2% 牛血清白蛋白(BSA,H1130,Solarbio,北京,中國)和 2 μg/mL TPCK-胰蛋白酶(9002-07-7,Macklin,上海,中國)的 DMEM 用于甲型流感病毒。在與微流控芯片平行的 96 孔板的實驗中,使用與芯片相同的介質。
人EV71(中國疫苗株,GenBank編號。HQ328793,武漢病毒研究所微生物和病毒培養物收集中心)和甲型流感病毒[A/Puerto Rico/8/1934(H1N1),武漢病毒研究所微生物和病毒培養物收集中心]分別在RD細胞和MDCK細胞中傳代了四個周期。所有感染實驗均在BSL-2實驗室進行。
2.3. 病毒滴度計算
在 96 孔板中接種 1 × 104 個細胞/孔的 RD 或 MDCK 細胞。將病毒的連續 10 倍稀釋液加入孔中。將細胞和稀釋的病毒一起孵育48小時后,在倒置顯微鏡的明場設置下檢查CPE,并按照Behrens-Reed-Muench方法計算病毒50%組織培養感染劑量(TCID50)。將所得病毒滴度為7 × 108 TCID50/mL(EV71,補充表S1)和1.6 × 108 TCID50/mL(甲型流感病毒,補充表S2),在-80°C下儲存直至進一步使用。在感染實驗中,感染的多重性(MOI)計算為病毒滴度PFU,其由TCID50(Bryan,1957)轉換而來,使用公式為:MOI = PFU /(接種細胞數)。
2.4. 芯片上細胞系培養
PDMS培養室涂有0.1mg / mL聚-l-賴氨酸(BS197,Biosharp,合肥,中國),滅菌,然后在4°C下儲存過夜。用磷酸鹽緩沖鹽水沖洗后,將芯片風干。將 A549、Vero、RD、BHK-21 或 MDCK 細胞以 1 × 104/孔的密度接種到芯片室中,與其他芯片組分組裝在一起進行連續靜態培養。芯片上的培養基是含有 1% FBS 的 DMEM,每 12 小時以 2 mL/h 的流速灌注 0.5 小時,直至培養過程結束。在接種后6小時和12小時,使用配備數碼相機的倒置顯微鏡(IX73,Olympus,Tokyo,Japan)對細胞進行成像。
2.5. 96孔板中的病毒感染
96 孔板中的細胞在指定的 MOI 處被 EV71(A549、Vero 和 RD 細胞)或流感病毒 H1N1(A549、Vero 和 MDCK 細胞)感染。在感染后指定的時間點,使用配備數碼相機的倒置顯微鏡(IX73,奧林巴斯)對細胞進行成像。
2.6. 芯片上的病毒感染
在感染前12小時將細胞接種在芯片的培養室中。然后,將包含加載單元的PDMS芯片小心地嵌入PLA框架中,其余的芯片組件按順序組裝。A549、Vero 和 RD 細胞在指定的 MOI 處感染 EV71。A549、Vero 和 MDCK 細胞在指定的 MOI 處感染流感病毒 H1N1。在感染后指定的時間點,使用配備數碼相機的倒置顯微鏡(IX73,奧林巴斯)對細胞進行成像。芯片上細胞排列(對應含病毒樣本的流向)為EV71感染的A549-Vero-RD、A549-RD-Vero或RD-A549-Vero,H1N1感染的A549-Vero-MDCK、A549-MDCK-Vero或MDCK-A549-Vero。每次感染試驗重復三次。
為了定量流感病毒H1N1 RNA,將A549、Vero和MDCK細胞接種在96孔板或如上所述的芯片上,然后在指定的MOI下感染流感病毒H1N1。同樣,樣本是在感染后指定的時間點冷凍后收獲的。采用甲型流感病毒核酸檢測試劑盒(DAJY-001-24T,中山大學大安基因有限公司,中國廣州)和一步法實時熒光PCR檢測病毒復制水平。樣品制備和反應系統按照制造商的說明進行。在Bio-Rad CFX Connect RT-qPCR儀器(CFX96)上處理樣品,并使用CFX Manager(3.1版)進行數據分析。
3. 結果
3.1. 微流控芯片的設計與組裝
從上到下,由PMMA(作為上蓋)、PLA(作為框架)、PDMS(作為培養芯片)和PMMA(作為下蓋)在金屬框架內組裝出微流控芯片器件。PDMS芯片的尺寸為70 mm×28 mm×3.3 mm,內置培養室直徑為6 mm,高度為2 mm。最初安裝芯片時,以 2 mL/h 的速率將培養基注入細胞室。為了通過提供足夠的營養和氧氣來支持細胞的生長,每 12 小時以 2 mL/h 的速度注入培養基 30 分鐘(圖 2)。每個細胞培養室的體積為56.52μL。每個芯片有 10 個腔室,單個芯片的總腔室體積為 565.2 μL。連接腔室和外部管路的微流體通道內的總體積為 314 μL。因此,腔室、通道和管道體積的總和為 879.2 μL,小于 1000 μL。因此,使用2 mL/h的流速30分鐘,進樣1000 μL新鮮培養基,足以替換整個芯片的培養基。
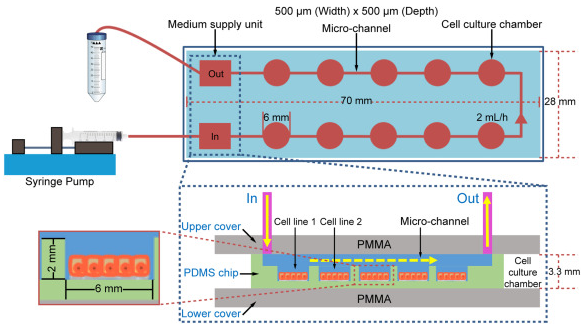
圖 2.微流控芯片的原理。PMMA,聚甲基丙烯酸甲酯;PDMS,聚二甲基硅氧烷。
這種設計的優點在于,通過使用三維(3D)打印,可以在短時間內實現定制的芯片通道結構(圖1)。與傳統的微流控細胞接種相比,細胞培養室的表面易于預處理,在單個芯片中也很容易實現不同細胞系的接種。此外,PDMS芯片可以在細胞接種完成后組裝成微流控器件,從而通過將各種PDMS芯片與不同的細胞集成來重建微流控芯片。
3.2. 在微流控芯片上培養不同細胞系
A549,Vero,RD,MDCK和BHK-21細胞系,它們對不同的病毒(包括腸道病毒,單純病毒,水皰病毒,埃博拉樣病毒和黃病毒)敏感(Phanthanawiboon等人,2014;Alonso 和 Compans,1981 年;Puhl 等人,2021 年;Shen 等人,2019 年;Xiao 等人,2020 年;Lee 和 Fuller,1993 年;Drews 等人,2019 年),被選為構建芯片時測試的潛在病毒允許細胞。然而,這些細胞需要不同的培養條件。BHK-21、MDCK 和 RD 細胞需要 MEM,而 A549 和 Vero 細胞需要 DMEM。為了在相同條件下在芯片上培養這些不同的細胞系,通過使細胞逐漸適應來建立含有 1% FBS 的 DMEM。結果,所有五種細胞系在接種后都能粘附在芯片的底物上,并顯示出正常的形態和活力(圖 3 和圖 4)。
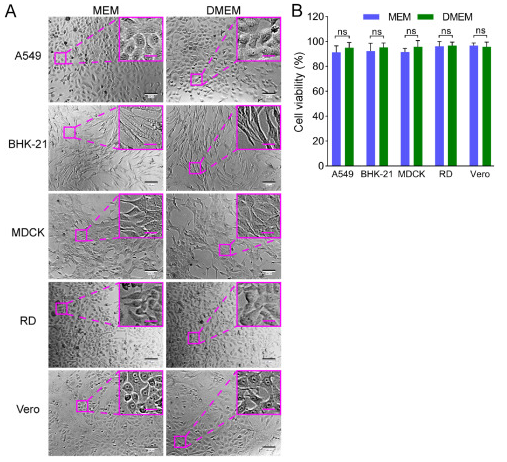
圖 3.在 96 孔板中比較在 MEM 與 DMEM 中培養的五種細胞系的細胞形態和活力,均含有 1% FBS。
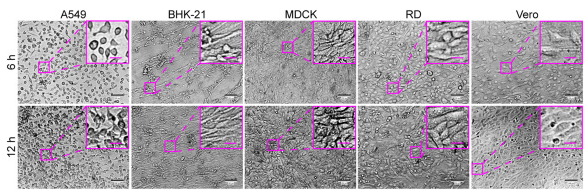
圖 4.在芯片上培養多種不同的細胞系。
3.3. 使用微流控芯片篩選 EV71 允許細胞的可行性
為了評估使用細胞芯片篩選病毒宿主細胞的可行性,選擇兩種眾所周知的病原體EV71和H1N1作為模型病毒。在正常情況下,當在適當的 MOI 下感染這些病毒時,允許培養的細胞表現出 CPE,例如由于病毒復制和釋放而呈圓形、收縮或細胞質起泡。
為了證明 EV71、A549、Vero 和 RD 細胞的典型 CPE,以 1 × 104 個細胞/孔的密度接種在 96 孔板中,并以 MOI 為 40 的 EV71 感染。所有三種細胞類型均表現出細胞病變變化,其中RD細胞在感染后24小時(hpi)表現出最顯著的變化(補充圖S1)。為了模擬用于 EV71 允許細胞篩選的臨床或現場樣品,將 A549、Vero 和 RD 細胞以與 96 孔板中相同的細胞密度接種到芯片上,并以 0.389 和 3.89 × 10?4 的低得多的 MOI 感染 EV71(圖 5)。與未感染病毒的對照細胞(補充圖S2)相比,在96孔板或芯片上分別在30(圖5A)和48(圖5D)hpi下培養的RD細胞上觀察到典型的CPE。盡管 96 孔板中的 Vero 細胞在 MOI 為 0.389 時也顯示出病變,但在兩種培養模式下,RD 細胞在 30 hpi 時表現出最典型的 CPE(圖 5A)。當使用RT-qPCR測量不同細胞系中EV71的病毒RNA拷貝數時,RD細胞對EV71增殖的支持最好,特別是在較低的MOI下(圖5B和E)。具體而言,在MOI為0.389時,來自96孔板的A549或Vero細胞培養物中的EV71 RNA拷貝數大于來自細胞芯片的拷貝數(圖5C)。這種差異可能是由于 96 孔板中的感染允許病毒顆粒和靶細胞上的受體與灌注芯片上的病毒顆粒和受體之間接觸的機會更高。相比之下,在MOI為0.000389時,A549和Vero細胞沒有觀察到這種差異,這可以通過以下事實來解釋:在超低MOI下,A549和Vero細胞中幾乎沒有發生EV71增殖(圖5F)。在兩種MOI中,RD細胞對EV71的增殖效率最高,96孔板和細胞芯片的EV71 RNA拷貝數無顯著差異。因此,根據細胞芯片培養結果,可以選擇RD細胞作為EV71的允許細胞系。這與RD細胞用于EV71培養的成熟使用一致,并與我們從96孔板(補充圖S1)的結果相匹配,表明基于細胞芯片的允許細胞篩選可以用作傳統板培養方法的替代品。
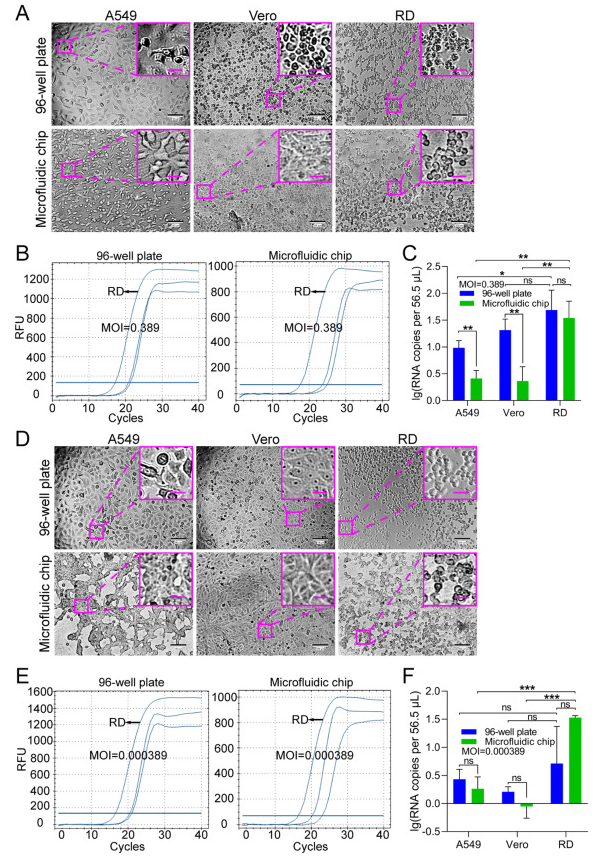
圖 5.使用微流控芯片篩選 EV71 允許細胞的可行性。
此外,考慮到病毒感染后允許的細胞可能釋放細胞因子,我們進一步測試了未感染或不太敏感的細胞系是否會受到最敏感細胞系的影響。我們調整了細胞系在微流控芯片上的排列順序,并進行了篩選實驗(圖6)。結果表明,無論細胞系以何種順序培養,RD細胞仍被“鑒定”為EV71的允許細胞系,支持允許細胞對非敏感或不太敏感的細胞系的潛在影響不會干擾使用微流控細胞芯片篩選病毒允許細胞的結果。
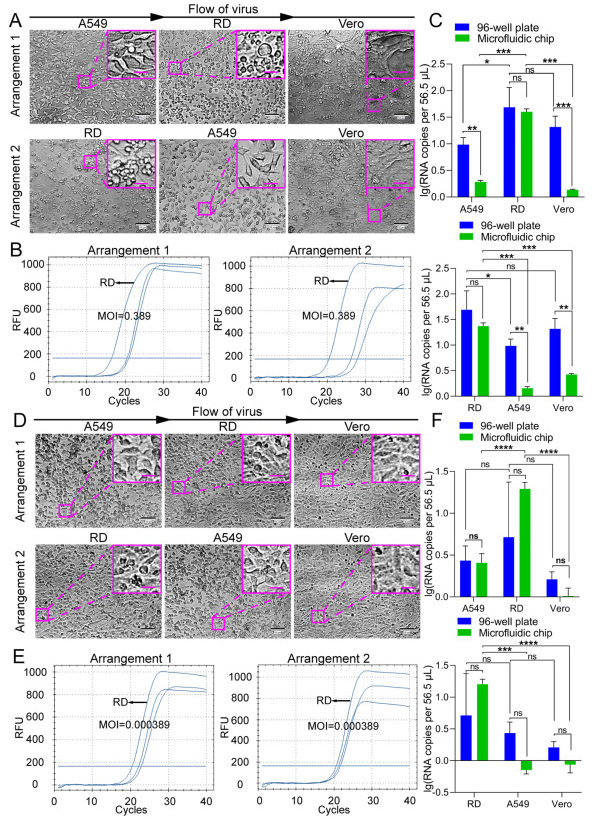
圖 6.EV71感染在微流控芯片上以不同排列方式接種的不同細胞系。
3.4. 使用微流控芯片篩選 H1N1 允許細胞的可行性
為了比較基于細胞芯片和傳統基于板的篩選,將 A549、Vero 和 MDCK 細胞接種在細胞芯片上或以 1 × 104 個細胞/孔的密度接種到 96 孔板中。流感病毒H1N1的培養需要TPCK處理的胰蛋白酶(TPCK-胰蛋白酶),因此將培養基優化為含有2%BSA和2μg/mL TPCK-胰蛋白酶的DMEM(補充圖S3)。首先允許流感病毒 H1N1 以 12.3 的 MOI 感染這些細胞,以證明 H1N1 的典型 CPE。在24 hpi時,MDCK細胞顯示出顯著的CPE,而其他細胞仍保持正常的細胞形態(補充圖S4)。
然后,在96孔板或微流控芯片上培養的細胞以0.012和0.00012的較低MOI感染H1N1,以模擬臨床或現場樣品進行H1N1允許細胞篩選(圖7)。在MOI為0.012時,與未感染病毒的對照細胞(補充圖S5)相比,在兩種培養模式下(圖7A)下,在72 hpi的MDCK細胞上觀察到典型的CPE,這與MDCK細胞系對EV71允許的知識一致。然而,在MOI為0.00012時,沒有一個細胞系顯示出明確的CPE(圖7D),這應該是由超低MOI引起的。為了進一步確認流感病毒H1N1可以在通過芯片培養“鑒定”為允許的細胞中復制,對培養物中的流感病毒H1N1 RNA進行了定量分析(圖7B和E)。在 MOI 為 0.012 或 0.00012 的 A549、Vero 和 MDCK 細胞感染流感病毒 H1N1 后,以 72 hpi 收集培養物,并使用帶有流感病毒 H1N1 聚合酶基因探針的 RT-qPCR 進行分析。在MOI為0.012時,病毒在兩種培養模式下在MDCK細胞中復制(圖7C)。雖然沒有統計學上的顯著差異,但在微流控芯片上培養的細胞中后代病毒的病毒RNA拷貝數略高于在96孔板中培養的細胞的病毒RNA拷貝數。然而,在MOI為0.00012時,在細胞芯片上的MDCK細胞中僅檢測到低水平的病毒復制,而在96孔板的MDCK細胞中未檢測到病毒復制(圖7F),這表明與傳統的基于平板的培養方法相比,細胞芯片可能對允許的細胞篩選更敏感。此外,我們還測試了未感染或不太敏感的細胞系是否會受到最敏感細胞系的影響。通過調整微流控芯片上細胞系的排列順序,我們發現無論細胞系以何種順序培養,MDCK細胞系都是H1N1的允許細胞系(圖8)。這些結果進一步支持了使用細胞芯片篩選病毒允許細胞的可行性。
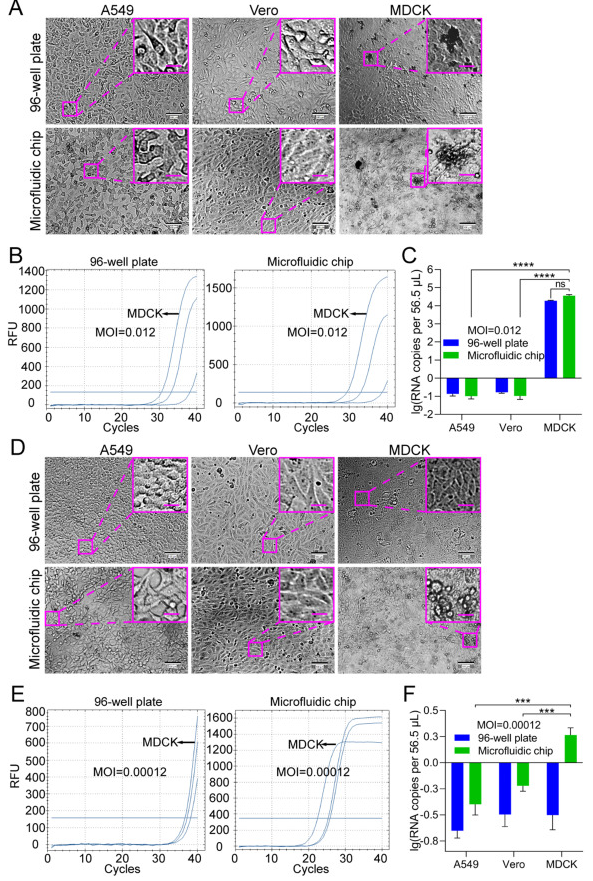
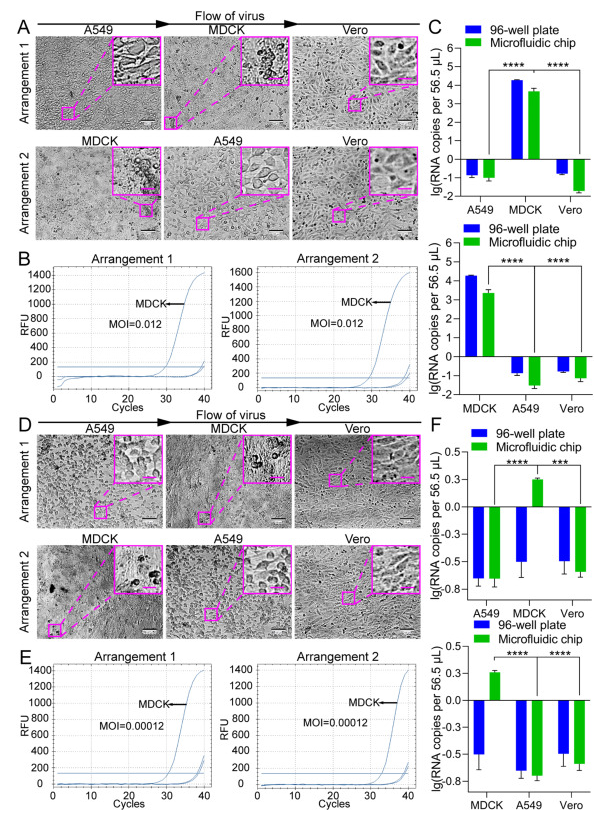
圖 7.用微流控芯片篩選H1N1允許細胞的可行性。 圖 8.H1N1感染不同細胞系以不同排列接種在微流控芯片上。
4. 討論
在這項研究中,已經制造了一種用于病毒培養的微流控細胞芯片,其工作原理如下。將多種候選細胞系接種在PDMS芯片的腔室中。當含有病毒的樣本流過腔室時,允許病毒的細胞系將被感染,導致CPE。因此,可以確定新出現的病毒的允許細胞系,同時,可以通過分子生物學技術培養病毒以進行分離和鑒定。
微流控在先進材料、制造方法和在生物學和醫學等各個領域的應用前景廣闊,顯示出巨大的潛力。在這里,通過使用強大的微流控技術,我們旨在開發一種用于病毒培養和分離的快速允許細胞篩選方法。為了使該方法簡單而穩健,我們應用了微流控電池芯片的簡單設計,并通過3D打印制備了帶有PDMS的芯片。芯片上有多個串聯的腔室,可以對病毒允許的細胞進行高通量篩選。此外,微流控細胞芯片可以集成到定制設備中,在高水平的生物安全控制下實現自動化高通量篩選和分離病毒。我們方法的優勢不在于細胞芯片的制造方式,而在于它將提供下一代病毒分離和鑒定模式,效率更高,研究人員暴露于潛在傳染性樣本的風險更低。事實上,以前已經報道過使用微流控芯片進行病毒感染研究。Warrick等人使用微流控芯片測量被水泡性口炎病毒感染的宿主細胞的細胞基因表達(Warrick等人,2016)。Guo等人制造了由PDMS層組成的微腔,以監測病毒感染時的細胞動力學(Guo等人,2017)。然而,在這些研究中描述的微流控芯片上僅培養了單個細胞系,而這里報道的微流控細胞芯片實現了五個不同細胞系的同時培養。為了成為一種強大的細胞篩選和病毒分離工具,我們芯片上的細胞系數量仍有待增加。原則上,可以通過簡單地增加細胞芯片上的腔室數量或設計平行芯片并分組或調整感興趣的細胞系來擴展培養細胞系的類型。使用細胞芯片進行病毒分離時要考慮的另一個問題是,樣本中可能存在兩種或多種類型的病毒,并且在試圖尋找特定傳染病的病原體時被分離出來。在這種情況下,應通過測序或其他分子生物學技術鑒定目標病毒。
該細胞芯片將符合感染性樣本操作中嚴格的生物安全要求。除了在篩選測定之前短暫暴露PDMS芯片外,細胞芯片設備在完全密封的條件下運行,可防止含有傳染性病原體的培養基泄漏。此外,根據生物安全法規,該設備用于培養病毒時,應放置在合格的生物安全柜中。此外,微流控細胞芯片可以集成到未來符合生物安全協議的定制設備中,以便所有步驟(即細胞接種、病毒感染、灌注、循環等)都可以在生物安全控制下的完全封閉空間內進行,這有利于自動化操作并降低研究人員暴露的風險。
5. 結論
綜上所述,通過預制芯片框架和定制PDMS芯片的快速組裝,制備了一種用于細胞培養的簡單微流控芯片。不同的PDMS芯片可以快速定制以滿足病毒識別需求,并重新組裝到這種微流控芯片中,這將有助于縮短從芯片設計到生產的時間。通過標準化培養條件,實現了多種常用于病毒增殖的代表性細胞系的培養。使用兩種模型病毒 EV71 和 H1N1 的感染實驗結果表明,微流控芯片系統通過支持在相應的已知宿主細胞系中開發典型 CPE,在識別病毒允許細胞方面效果良好。與傳統的基于平板的病毒培養和分離方法相比,該細胞芯片系統具有更高的通量和更小的樣品需求。此外,通過與必要的控制模塊或設備集成,系統可以實現全自動,從而節省時間。本文所述的基于細胞芯片的培養系統為識別病毒允許的細胞和分離新出現的病毒提供了一種快速有效的方法,這將有助于對抗病毒性疾病。此外,這里制造的細胞芯片還可用于微納米材料的細胞毒性研究、抗病毒藥物篩選等。
免責聲明:文章來源網絡 以傳播知識、有益學習和研究為宗旨。 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。
標簽: 微流控細胞芯片