灌流細(xì)胞培養(yǎng)及穩(wěn)態(tài)操作
N-階段灌流細(xì)胞培養(yǎng)
在生產(chǎn)生物反應(yīng)器中,即通常所指的N-階段生物反應(yīng)器,細(xì)胞培養(yǎng)可在開始階段快速達(dá)到超過(guò)系統(tǒng)容量的生物質(zhì)水平,但由于營(yíng)養(yǎng)或設(shè)備限制,細(xì)胞活性會(huì)快速降低。為防止這一情況的發(fā)生,可通過(guò)控制細(xì)胞密度的方法,在更長(zhǎng)的生產(chǎn)期內(nèi),維持生物質(zhì)恒定。當(dāng)同時(shí)考慮N-1和N階段時(shí),可采用不同的策略,批次、補(bǔ)料分批和灌流模式可通過(guò)不同的方式而被改變。參考原文介紹了最近的一些關(guān)于在合理的更長(zhǎng)時(shí)間的高密度灌流細(xì)胞培養(yǎng)中、使用不同的方法來(lái)控制并維持穩(wěn)態(tài)的案例。
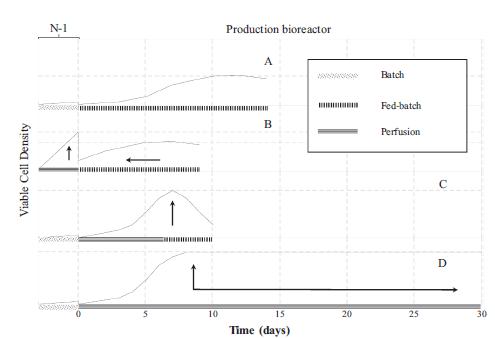
N-1和生產(chǎn)(N-階段)生物反應(yīng)器不同操作策略的示意圖(A)N-1批次 & 生產(chǎn)生物反應(yīng)器補(bǔ)料分批(B)N-1灌流 & 生產(chǎn)生物反應(yīng)器高密度接種補(bǔ)料分批(C)N-1批次 & 生產(chǎn)階段開始灌流,以快速提高生物質(zhì),之后補(bǔ)料分批操作(D)N-1批次 & 生產(chǎn)生物反應(yīng)器灌流,并控制細(xì)胞密度。箭頭指示在不同案例中使用灌流技術(shù)的優(yōu)勢(shì):可用于接種的更高的生物質(zhì)、更短的生產(chǎn)時(shí)間(B);生產(chǎn)階段更高的生物質(zhì)(C);生產(chǎn)階段更高的生物質(zhì)以及更長(zhǎng)的運(yùn)行時(shí)間(J.Bielser,et al., 2018)。
半連續(xù)和連續(xù)廢棄分別根據(jù)每日離線細(xì)胞計(jì)數(shù)或在線生物質(zhì)傳感器監(jiān)測(cè)結(jié)果進(jìn)行。每日廢棄會(huì)導(dǎo)致一種不連續(xù)的“鋸齒狀”行為,在兩個(gè)相鄰的廢棄點(diǎn)之間,細(xì)胞密度連續(xù)增加,而在廢棄點(diǎn)顯著下降,這種方法可以在沒有在線監(jiān)測(cè)和控制使用。另一種替代方法是,根據(jù)細(xì)胞計(jì)數(shù),每日調(diào)節(jié)連續(xù)廢棄,可獲得更加穩(wěn)定的反應(yīng)器行為,這種策略與半連續(xù)方法的區(qū)別在于連續(xù)的細(xì)胞去除,但細(xì)胞生產(chǎn)在某一時(shí)間點(diǎn),還是會(huì)發(fā)生偏差。所以,最應(yīng)選擇的方法是使用在線生物質(zhì)傳感器,將其檢測(cè)值與廢棄流速直接耦連,以維持預(yù)先確定的設(shè)定值。
Dowd等使用聲學(xué)過(guò)濾器和0.05 - 0.4 nL/cell/day的CSPR,維持~50 x 10^6 cells/mL活細(xì)胞密度的穩(wěn)態(tài)操作5天。Clincke等報(bào)導(dǎo)使用TFF,以~1.44VVD的灌流速率,達(dá)到20 - 35 x 10^6 cells/mL的活細(xì)胞密度。使用ATF,以4.5 - 5 vvd-1的灌流速率,維持90 - 130 x 10^6 cells/mL的活細(xì)胞密度2周。Karst等報(bào)導(dǎo)使用ATF和TFF,將活細(xì)胞密度維持在20、60和40 x 10^6 cells/mL,穩(wěn)態(tài)操作10天,灌流速率在1.06 - 1.44 vvd-1之間。根據(jù)目標(biāo)灌流速率,使用不同百分比的高濃度補(bǔ)液對(duì)化學(xué)限定培養(yǎng)基進(jìn)行富集。Warikoo等報(bào)導(dǎo)了50 - 60 x 10^6 cells/mL的活細(xì)胞密度穩(wěn)態(tài)操作維持約50天,以及使用ATF和0.04 - 0.05 nL/cell/day的CSPR進(jìn)行活細(xì)胞密度50 x 10^6 cells/mL(CHO,rhenzyme)的操作。Xu等報(bào)導(dǎo)了細(xì)胞密度分別在42和68 x 10^6 cells/mL的穩(wěn)態(tài)操作,使用手動(dòng)細(xì)胞廢棄,最低CSPR為15和23 pL/cell/day。
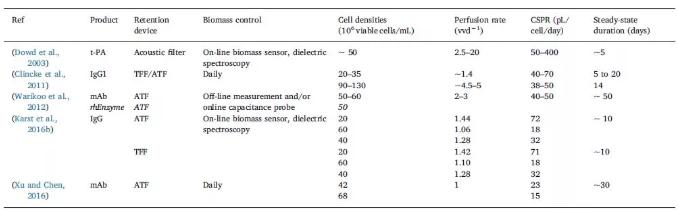
CHO細(xì)胞灌流培養(yǎng)生物反應(yīng)器穩(wěn)態(tài)操作條件示例(J.Bielser,et al., 2018)。
使用非常相似的培養(yǎng)基比較不同工藝的性能,Xu等對(duì)各自產(chǎn)率進(jìn)行了“公平”的比較,包括批次、補(bǔ)料分批(高或低密度接種)、濃縮補(bǔ)料分批以及灌流工藝。結(jié)果發(fā)現(xiàn),所有生產(chǎn)模式中的細(xì)胞特異性產(chǎn)率范圍相似,所以反應(yīng)器最終的單位體積產(chǎn)率取決于工藝所能達(dá)到的細(xì)胞密度。對(duì)于灌流、高接種密度以及補(bǔ)料分批,觀察到的產(chǎn)率值分別為2.29g/L/day、2.04g/L/day以及0.39-0.49g/L/day,這說(shuō)明連續(xù)工藝可顯著強(qiáng)化工藝。
穩(wěn)態(tài)或穩(wěn)定操作
下圖所繪的設(shè)置包含了在線監(jiān)測(cè)和廢棄率的控制,可實(shí)現(xiàn)在穩(wěn)定細(xì)胞密度條件下的連續(xù)操作。其結(jié)果是,生物反應(yīng)器內(nèi)的環(huán)境達(dá)到恒定狀態(tài),具有固定的生物質(zhì)或細(xì)胞密度,即通常所指的穩(wěn)態(tài)操作。按照其定義,在穩(wěn)態(tài)下,沒有產(chǎn)物積聚在系統(tǒng)內(nèi),進(jìn)入(IN)、離開(OUT)反應(yīng)器以及所生產(chǎn)/消耗的物質(zhì)的總和為零。相應(yīng)地,反應(yīng)器內(nèi)所有的濃度和物理參數(shù)隨時(shí)間保持恒定,在一定程序上,必需是攪拌良好的罐,這些樹脂在整個(gè)反應(yīng)器體積范圍內(nèi)保持均一。
除了由化學(xué)反應(yīng)或由于不同進(jìn)/出液流而形成的成分的添加/去除外,在生物反應(yīng)器內(nèi),還會(huì)發(fā)生其它一些過(guò)程,其與細(xì)胞生物學(xué)相關(guān),且其動(dòng)力學(xué)特性通常相對(duì)較慢。生物學(xué)反應(yīng)速率不是恒定的,在工藝中,可能隨時(shí)間發(fā)生變化。由于灌流操作的時(shí)間會(huì)延長(zhǎng)到數(shù)天、數(shù)周甚至數(shù)月,這種緩慢的過(guò)程可能最終會(huì)形成不可忽略的成分,且在運(yùn)行過(guò)程中導(dǎo)致緩慢的“漂移”。例如,由于某些類型的細(xì)胞衰老過(guò)程,細(xì)胞特異性產(chǎn)率會(huì)隨時(shí)間降低。所以在描述灌流生物反應(yīng)器時(shí),“穩(wěn)態(tài)”這個(gè)詞的使用需要小心,而且需要記住的是,整體的系統(tǒng)總會(huì)緩慢地“漂離”初始描述的穩(wěn)態(tài)。
穩(wěn)態(tài)操作已被證實(shí),如Karst等使用代謝組學(xué)技術(shù),在不同的操作狀態(tài)下觀察了代謝物的濃度,如核苷酸、核糖和脂質(zhì)前體。在以穩(wěn)定操作3天后,可觀察到代謝性穩(wěn)態(tài)。有趣的是,在另一項(xiàng)研究顯示在6至7天的過(guò)渡后細(xì)胞內(nèi)過(guò)程才達(dá)到穩(wěn)態(tài)條件,如糖基化。Bertrand等使用轉(zhuǎn)錄組學(xué)和蛋白組學(xué)研究了細(xì)胞內(nèi)、外代謝物的動(dòng)態(tài)過(guò)程,鑒定了3組轉(zhuǎn)錄物,第一組在3天后達(dá)到穩(wěn)態(tài)(大部分)、第二組在7天后達(dá)到穩(wěn)態(tài)(中間組)、最后一組沒有達(dá)到穩(wěn)態(tài)(小部分)。這說(shuō)明,即使可以達(dá)到了穩(wěn)定操作,即許多、甚至大部分代謝物達(dá)到了細(xì)胞內(nèi)或外穩(wěn)態(tài),仍然會(huì)有部分生物學(xué)過(guò)程,在運(yùn)行過(guò)程中會(huì)發(fā)生變化,但其可能只有極小的宏觀影響。
另一個(gè)常用詞是穩(wěn)定操作,用于描述將關(guān)鍵工藝參數(shù)和質(zhì)量屬性維持在良好確定的范圍內(nèi)的操作。報(bào)導(dǎo)顯示,一些較小的干擾可使系統(tǒng)偏離穩(wěn)定操作設(shè)定點(diǎn),但使用良好確定的控制策略,其可被快速校正,使對(duì)產(chǎn)物質(zhì)量的影響最小化。這就是對(duì)“穩(wěn)定”這個(gè)詞的定義,指示了可提供具有在預(yù)先確定的界線或范圍內(nèi)的產(chǎn)物質(zhì)量屬性的反應(yīng)器條件范圍。
本文節(jié)選自以下文章,因水平有限,如有不當(dāng)之處,敬請(qǐng)諒解。完整的詳細(xì)內(nèi)容,請(qǐng)參考原文。
參考原文:J.Bielser, M.Wolf, J.Souquet, et al., Perfusion mammalian cell culture for recombinant protein manufacturing - A critical review. Biotechnology Advances, 2018, 36:1328-1340.
免責(zé)聲明:文章來(lái)源《 生物咖啡茶》-微信公眾號(hào) 以傳播知識(shí)、有益學(xué)習(xí)和研究為宗旨。 轉(zhuǎn)載僅供參考學(xué)習(xí)及傳遞有用信息,版權(quán)歸原作者所有,如侵犯權(quán)益,請(qǐng)聯(lián)系刪除。